
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота № 3. Тема: Потенціометричний метод аналізу
|
|
|
|
Тема: Потенціометричний метод аналізу.
Мета: Визначити вміст натрiй гiдрогенкарбонату в технічному динатрiй карбонатi. Визначити масову частку NO3- в овочах.
Теоретична частина
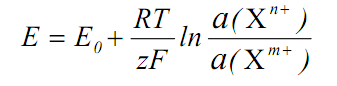
Потенціометрія, як метод аналізу заснована на використанні рівняння Нернста, що поєднує потенціал електрода з активністю, або концентрацією потенцiалвизначаючих частинок в розчині. Так як у ролі останніх завжди виступають iони, то тепер набула розповсюдження альтернативна назва методу – іонометрiя.
де Е0 – стандартний електродний потенцiал, В; R – унiверсальна газова стала, дорiвнює 8,314 Дж/(моль×К); Т – температура, К; z – кількість електронiв, що беруть участь в електроднiй реакцiї: z = n – m; F – стала Фарадея, дорiвнює 96500 Кл/моль; a(Хn+) i a(Xm+) – активностi окисненої та вiдновленої форми Х, моль/дм3. Це рiвняння у випадку гетерогенних рiвноваг, наприклад, якщо відновленою формою є матерiал електрода, спрощується:

Коефіцієнт активності (g) є функцією концентрації iонiв, або іонної сили розчину m, яка визначається як напівсума добуткiв концентрацiї на квадрат заряду всiх іонiв, що присутнi в розчинi:
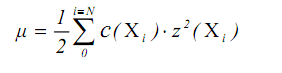
У випадку, при 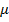 0 то
0 то  1, тому якщо потенціометричні виміри проводяться в розведених розчинах (
1, тому якщо потенціометричні виміри проводяться в розведених розчинах (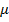 < 10 –2 моль/дм3), то в рівняння Нернста можна підставляти концентрації замість активностей. Можна також створити умови за яких
< 10 –2 моль/дм3), то в рівняння Нернста можна підставляти концентрації замість активностей. Можна також створити умови за яких 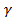 =const, ввівши в аналізований розчин інший електроліт (фон) з великою концентрацією. Для цього випадку рівняння (6.1.2) запишеться таким чином:
=const, ввівши в аналізований розчин інший електроліт (фон) з великою концентрацією. Для цього випадку рівняння (6.1.2) запишеться таким чином:
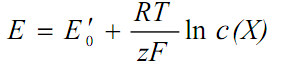
де Е'0 – умовний стандартний електродний потенціал, термодинамічний зміст якого не визначений. Потенціюючи рівняння (6.1.4) отримаємо:
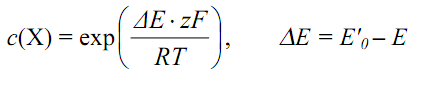
Рівняння (6.1.5) лежить в основі прямої потенціометрії. При потенцiометричному титруваннi визначають зміну електродного потенціалу, як функцію об’єму титрованого розчину реактиву, що реагує з визначуваним компонентом. Дослідження цієї функції, а також її першої та другої похідних дозволяє визначити точку еквівалентності при титруванні. Потенціометричне титрування виконується за допомогою типової потенціометричної установки з комп’ютерною реєстрацією результатів вимірювання (рис. 6.1.1). Така схема є основою для побудови автоматичних аналізаторів та систем промислового регулювання. Потенціометричний датчик являє собою електрохімічну систему, на одному з електродів якої (індикаторному) реалізується рівновага з участю частинок визначуваного компонента; другий електрод є допоміжним. Його потенціал не повинен залежати від складу розчину. Це досягається використанням електродів другого роду та електролітичних містків. Аналітичним сигналом є різниця потенціалів між електродами датчика. Один з електродів має стале значення потенціалу, отже величина цієї різниці залежить лише від стрибка потенціалу, що виникає між розчином та індикаторним електродом. Незалежно від типу та конструкції цього електрода на ньому завжди реалізується рівновага за участю іонів визначуваного компонента, або іонів які дають аналітичну реакцію з визначуваним компонентом.

Оскільки матеріали, що використовуються для виготовлення iон-селективних електродів (скло, iонообмiннi смоли, монокристали солей) мають високий електричний опiр, то загальний опір потенціометричних датчиків у ряді випадків сягає 108Ом.

1 – срібна дротина, вкрита шаром AgCl; 2 – пробка, що закриває корпус електрода порівняння; 3 – азбестовий гніт; 4 – насичений розчин КCl; 5 – капіляр, заповнений асбестовими волокнами; 6 – внутрішній електрод порівняння; 7 – тверді іонообмінні мембрани; 8 – рідинна іонообмінна мембрана; 9 – дротина з інертного металу (Pt, Pd, Au), на кінчику якої плавленям сформовано кульку; 10 – монокристал важкорозчинної солі (LaF3, Ag2S, та інш.) Через цю обставину вторинний вимірювальний перетворювач, що приймає сигнал датчика повинен мати вхідний опір ще на 3-4 порядки вищий. Тому сигнал спочатку подається на спеціальний електрометричний підсилювач, що є основою будь-якого іономiра чи рН-метра.
Практична частина
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 322; Нарушение авторских прав?; Мы поможем в написании вашей работы!