
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язання задач
|
|
|
|
Приклад 1. На основі електронної формули елемента з порядковим номером 23 визначити, в якому періоді, групі та підгрупі він знаходиться та його основні хімічні властивості.
Розв’язання. Електронна оболонка атома з порядковим номером 23 має вигляд: 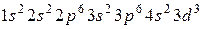 .
.
Елемент з порядковим номером 23 знаходиться в IV періоді, бо містить 4 енергетичні рівні; належить до d -елементів, тому що останнім заповнюється
d- підрівень;у п’ятій групі, оскільки для d -елементів номер групи визначається числом електронів на зовнішньому s -підрівні та передзовнішньому d -підрівні; в побічній підгрупі, бо всі d -елементи утворюють побічні підгрупи. Цей елемент– ванадій (V).
Атом ванадію може легко віддавати 2 електрони, які розташовані на 4 s- підрівні, виявляючи ступінь окиснення +2. При цьому він утворює оксид VO та гідроксид 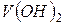 , що мають основні властивості. Газоподібних водневих сполук ванадій не утворює, бо знаходиться в побічній підгрупі.
, що мають основні властивості. Газоподібних водневих сполук ванадій не утворює, бо знаходиться в побічній підгрупі.
Атом ванадію може також віддавати електрони з d - підрівня передостаннього енергетичного рівня (3 електрони), виявляючи найвищий ступінь окиснення +5 (чисельно він дорівнює номеру групи, в якій знаходиться елемент). Оксид, що відповідає найвищому ступеню окиснення, має формулу 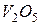 . Цей оксид виявляє кислотні властивості. Йому відповідає нестійка метаванадієва кислота
. Цей оксид виявляє кислотні властивості. Йому відповідає нестійка метаванадієва кислота 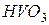 , її солі, ванадати, стійкі сполуки.
, її солі, ванадати, стійкі сполуки.
Приклад 2. Який з елементів, літій чи калій, виявляє більш виражені металічні властивості?
Розв’язання. Будови електронних оболонок атомів літію і калію мають вигляд:
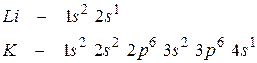
Обидва атоми на зовнішньому енергетичному рівні мають по одному електрону. Але в атомі калію зовнішній електрон більш віддалений від ядра (розташований на четвертому енергетичному рівні, а в атомі літію – на другому), тому він легше відривається. Оскільки металічні властивості обумовлені здатністю віддавати електрони, вони сильніше виражені в калію.
Приклад 3. Визначити найвищий і найнижчий ступені окиснення брому. Скласти формули сполук брому, що відповідають даним ступеням окиснення.
Розв’язання. Найвищий ступінь окиснення елемента визначається номером групи періодичної системи елементів, в якій він знаходиться. Найнижчий ступінь окиснення відповідає умовному заряду, який матиме атом, якщо приєднає електрони, що необхідні для утворення стійкої восьмиелектронної оболонки ( ).
).
Бром знаходиться в VII групі та має структуру зовнішнього енергетичного рівня 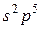 . Тому для нього найвищий ступінь окиснення +7, а найнижчий –1, їм відповідають сполуки
. Тому для нього найвищий ступінь окиснення +7, а найнижчий –1, їм відповідають сполуки 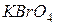 та
та  .
.
Приклад 4. Які сполуки з воднем утворюютьелементи головної підгрупи VI групи? Визначити найбільш і найменш стійкі з них.
Розв’язання. Елементи головної підгрупи VIгрупи є р -елементами. Їхні атоми на зовнішньому енергетичному рівні мають по 6 електронів:  . Тому в сполуках з воднем вони виявляють ступінь окиснення -2. Формули відповідних сполук:
. Тому в сполуках з воднем вони виявляють ступінь окиснення -2. Формули відповідних сполук: 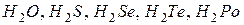 .
.
Із зростанням порядкового номера елемента (від кисню до полонію) збільшується радіус атома, що обумовлює зменшення міцності сполуки з воднем. Таким чином, найбільш стійкою сполукою є  , а найменш стійкою -
, а найменш стійкою - 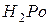 .
.
Приклад 5. У якого з елементів четвертого періоду, марганцю чи брому, сильніше виражені металічні властивості?
Розв’язання. Марганець – d -елемент VIIгрупи, а бром – р -елемент VIIгрупи. На зовнішньому енергетичному рівні атома марганцю міститься 2 електрони, атома брому – сім. Атоми типових металів характеризуються наявністю невеликої кількості електронів на зовнішньому енергетичному рівні і, відповідно, здатністю легко втрачати ці електрони. Вони мають лише відновні властивості та не утворюють елементарних негативних іонів.
Елементи, атоми яких на зовнішньому енергетичному рівні містять більше трьох електронів, характеризуються певною спорідненістю до електрона, відповідно, можуть мати негативний ступінь окиснення і навіть утворювати елементарні негативні іони. Таким чином, марганець, як і всі метали, виявляє лише відновні властивості. Бром виявляє слабкі відновні властивості, для нього більш характерні окисні функції. Загальною закономірністю для всіх груп, що містять р- і d - елементи, є перевага металічних властивостей у d - елементів. Отже, металічні властивості більше виражені в марганцю, ніж у брому.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1024; Нарушение авторских прав?; Мы поможем в написании вашей работы!