
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні поняття та визначення. Електрохімічні процеси - процеси, при яких відбуваються перетворення хімічної енергії в електричну і навпаки. Рівняння Нернста для
|
|
|
|
ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
| Електрохімічні процеси | - процеси, при яких відбуваються перетворення хімічної енергії в електричну і навпаки. |
| Рівняння Нернста для електродного потенціалу металу | -  де
де  - електродний потенціал металу, В; - електродний потенціал металу, В;
 - стандартний електродний потенціал металу, В; - стандартний електродний потенціал металу, В;
 - універсальна газова стала;
Т - температура, К;
n – число електронів, які приймають участь у процесі;
F – число Фарадея, Кл/моль; - універсальна газова стала;
Т - температура, К;
n – число електронів, які приймають участь у процесі;
F – число Фарадея, Кл/моль;
 - активність іонів металу. - активність іонів металу.
|
| Рівняння Нернста для розбавлених розчинів при Т=298К | -  . .
|
| Стандартний потенціал металічного електрода | - електродний потенціал металу, зануреного в розчин власних іонів з активністю (концентрацією) 1 моль/л, виміряний за стандартних умов відносно стандартного водневого електрода. |
| Гальванічний елемент | - прилад, в якому енергія хімічної окисно-відновної реакції перетворюється на електричну. |
| Анод | - електрод, на якому відбувається процес окиснення. |
| Катод | - електрод, на якому відбувається процес відновлення. |
| Електрорушійна сила гальванічного елемента ЕРС | - ЕРС =  ,
де ,
де  і і 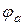 - електродні потенціали катода і анода. - електродні потенціали катода і анода.
|
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 261; Нарушение авторских прав?; Мы поможем в написании вашей работы!