
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади виконання завдань. Електроліз електроліз - сукупність окисно-відновних процесів, які відбуваються під дією постійного електричного струму на електродах
|
|
|
|
ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ
ЕЛЕКТРОЛІЗ
| Електроліз | - сукупність окисно-відновних процесів, які відбуваються під дією постійного електричного струму на електродах, занурених у розчин або розплав електроліту. На катоді відбувається процес відновлення, а на аноді – окиснення. |
| Об’єднаний закон Фарадея | - маса речовини, яка виділяється або розкладається на електродах під час електролізу, пропорційна кількості електрики, що проходить через розчин або розплав і не залежить від інших факторів:
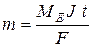 ,
де ,
де 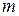 - маса окисненої або відновленої речовини, г; - маса окисненої або відновленої речовини, г;
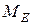 - молярна маса еквівалента речовини, г/моль; - молярна маса еквівалента речовини, г/моль;
 - сила струму, А; - сила струму, А;
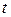 - час, с; - час, с;
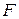 - стала Фарадея, Кл/моль. - стала Фарадея, Кл/моль.
|
Приклад 1. Скласти рівняння катодного і анодного процесів, які відбуваються при електролізі водного розчину хлориду міді (II) з графітовими електродами.
Відповідь. У водному розчині хлориду міді (II) відбуваються процеси дисоціації:

На катоді відновлюється найбільш активний окисник з найбільшим значенням електродного потенціалу. У даному випадку можливе відновлення як іонів міді
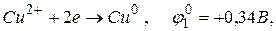
так і молекул води

Оскільки 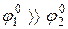 , то на катоді виділяється саме мідь.
, то на катоді виділяється саме мідь.
На аноді окиснюється найбільш активний відновник з найменшим значенням електродного потенціалу. У даному випадку можливе окиснення як хлорид-іонів
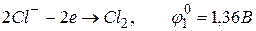 ,
,
так і молекул води
 .
.
Хоч 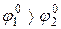 , однак здійснюється саме окиснення хлорид-іону, що обумовлено значною перенапругою другого процесу.
, однак здійснюється саме окиснення хлорид-іону, що обумовлено значною перенапругою другого процесу.
Приклад 2. Написати рівняння процесів, які відбуваються при електролізі водного розчину нітрату цинку з цинковим анодом.
Відповідь. У водному розчині нітрату цинку відбуваються процеси дисоціації:
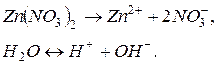
Стандартний електродний потенціал системи
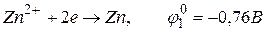
близький до потенціалу розряду молекул води
 .
.
Тому на катоді відновлюються одночасно і іони цинку і молекули води.
На аноді відбуватиметься процес окиснення металічного цинку (матеріалу електрода), оскільки йому відповідає найменший електродний потенціал порівняно з потенціалами води та іонів 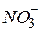 .
.
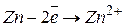 .
.
Приклад 3. Скласти рівняння катодного і анодного процесів, які відбуваються при електролізі розплаву суміші солей  та
та 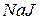 з інертним анодом. Яка маса міді виділиться на катоді при проходженні струму силою 4А протягом однієї години?
з інертним анодом. Яка маса міді виділиться на катоді при проходженні струму силою 4А протягом однієї години?
Розв’язання. У розплаві відбувається дисоціація солей:

На катоді можуть відновлюватися іони міді:
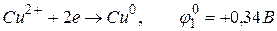 ,
,
і іони натрію:
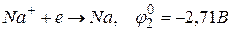 .
.
Оскільки  , то відновлюватися будуть, в першу чергу, іони міді.
, то відновлюватися будуть, в першу чергу, іони міді.
На аноді в першу чергу розряджуються йодид-іони

відповідно до послідовності розрядження аніонів на інертному аноді
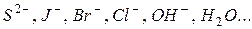
Для розрахунку маси міді, яка виділяється на катоді використовуємо об’єднаний закон Фарадея:

 .
.
Оскільки молярна маса еквівалента міді дорівнює  (г/моль), то
(г/моль), то
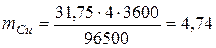 (г).
(г).
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 412; Нарушение авторских прав?; Мы поможем в написании вашей работы!