
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні вказівки. Питання для самоперевірки
ЕЛЕКТРОЛІТІВ
ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ. РЕАКЦІЇ В РОЗЧИНАХ
Лабораторна робота № 7
Питання для самоперевірки
1. Чим виражається склад розчину?
2. Скільки грамів  міститься в 100 мл 0,1 н розчину
міститься в 100 мл 0,1 н розчину  ?
?
3. Визначити молярну і нормальну концентрації 30%-ного розчину сірчаної кислоти.
4. Що таке титр розчину? Які розчини називаються титрованими?
5. У чому полягає процес титрування?
Мета роботи - вивчення хімічної рівноваги та можливості перебігу реакцій в розчинах електролітів.
При виконанні лабораторної роботи студенти повинні знати, що електроліти – це речовини, які розпадаються в розчинах або розплавах на позитивно заряджені іони (катіони) і негативно заряджені іони (аніони). Процес розпаду молекул на іони – електролітична дисоціація – відбувається під дією полярних молекул розчинника. При цьому одні речовини розпадаються на іони повністю (сильні електроліти), а інші лише частково (слабкі електроліти).
До сильних електролітів належать майже всі солі, деякі мінеральні кислоти ( ) і основи, утворені лужними та лужноземельними металами (
) і основи, утворені лужними та лужноземельними металами (
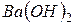 .
.
До слабких електролітів належать вода, практично всі органічні кислоти, деякі мінеральні кислоти ( ), а також основи, утворенні
), а також основи, утворенні  - металами, та
- металами, та  .
.
Здатність електролітів до дисоціації на іони визначається ступенем дисоціації 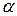 і константою дисоціації К.
і константою дисоціації К.
 ,
,
де  - число молекул, що розщепилися на іони;
- число молекул, що розщепилися на іони;
 - загальне число розчинених молекул.
- загальне число розчинених молекул.
 (для електроліту КА)
(для електроліту КА)
Необхідно звернути увагу на те, що більш універсальною характеристикою сили електроліту є константа дисоціації, оскільки К, як і 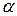 , залежить від природи розчиненої речовини і розчинника та від температури, але на відміну від
, залежить від природи розчиненої речовини і розчинника та від температури, але на відміну від 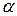 не залежить від концентрації розчину.
не залежить від концентрації розчину.
Слід мати на увазі, що багатоосновні кислоти і багатокислотні основи дисоціюють ступінчасто. Наприклад:
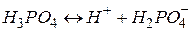 /перший ступінь/
/перший ступінь/
 /другий ступінь/
/другий ступінь/
 /третій ступінь/
/третій ступінь/
У водних розчинах електролітів необхідно враховувати дисоціацію води як слабкого електроліту:

Іонний добуток води [ 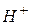 ] · [
] · [ 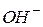 ] для будь-яких водних розчинів є постійною величиною, рівною 10 -14 (t =220C).
] для будь-яких водних розчинів є постійною величиною, рівною 10 -14 (t =220C).
Для характеристики реакції середовища доцільно користуватися водневим показником 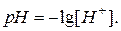 У нейтральних розчинах
У нейтральних розчинах  , в кислих
, в кислих  , у лужних
, у лужних  .
.
Для якісного визначення реакції середовища застосовують індикатори, колір яких змінюється в залежності від величини  розчину. Найчастіше використовують такі індикатори: лакмус, фенолфталеїн і метилоранж.
розчину. Найчастіше використовують такі індикатори: лакмус, фенолфталеїн і метилоранж.
Необхідно пам’ятати, що реакції обміну в розчинах електролітів практично відбуваються в бік утворення осаду (малорозчинних речовин), газів (летких речовин) і слабких електролітів (малодисоційованих сполук).
При складанні іонних рівнянь реакцій треба керуватися тим, що сильні розчинні електроліти, як практично повністю дисоційовані, пишуться у вигляді іонів, а речовини малодисоційовані, малорозчинні і газоподібні записують у молекулярній формі.
|
|
Дата добавления: 2015-05-23; Просмотров: 341; Нарушение авторских прав?; Мы поможем в написании вашей работы!