
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні вказівки. Питання для самоперевірки
|
|
|
|
ГІДРОЛІЗ СОЛЕЙ
Питання для самоперевірки
Оформлення результатів роботи
Дослід 2. Реакції в розчинах електролітів.
1. У пробірку налити 2-3 мл розчину нітрату калію і додати туди стільки ж розчину хлориду натрію. Відзначити, що відбувається.
2. Налити в одну пробірку 2 мл розчину сульфату магнію, в другу стільки ж розчину сульфату хрому, в третю – сірчаної кислоти. У кожну з пробірок додати по 3 мл хлориду барію. Відзначити, що відбувається.
3. Налити в одну пробірку 2 мл розчину сульфату хрому, в другу стільки ж розчину хромату калію і додати в кожну з них по кілька крапель розчину гідроксиду калію. Відзначити, що відбувається в кожній пробірці.
4. Налити в пробірку 2 мл розчину карбонату натрію і додати туди стільки ж розчину соляної кислоти. Відзначити, що відбувається.
Дослід 1. Написати рівняння дисоціації оцтової кислоти і гідроксиду амонію, вираз швидкостей прямої і зворотної реакцій, а також констант дисоціації для вказаних рівноважних систем. Записати рівняння дисоціації ацетату натрію і хлориду амонію.
Зробити висновок щодо причини зміни забарвлення розчинів.
Зробити загальний висновок про вплив додання однойменного іону на дисоціацію слабкого електроліту.
Дослід 2. Написати рівняння реакцій в молекулярній та іонній формах.
На якій основі можна зробити висновок про те, що реакції в розчинах електролітів відбуваються між іонами, а не між молекулами? Пояснити, в яких випадках відбуваються реакції в розчинах електролітів.
1. Що таке електроліти та неелектроліти?
2. Який процес називається електролітичною дисоціацією?
3. Що таке ступінь та константа дисоціації? Від яких факторів вони залежать?
4. За якою ознакою електроліти поділяють на слабкі та сильні?
5. В яких випадках можуть відбуватися реакції в розчинах електролітів?
6. Написати рівняння ступінчатої дисоціації сірководневої кислоти і вираз для констант дисоціації.
Лабораторна робота № 8
Мета роботи - вивчення реакції середовища в розчинах різних солей а також факторів, які впливають на перебіг гідролізу.
Гідроліз є реакцією обмінної взаємодії іонів розчиненої солі з водою, в результаті якої утворюються малодисоційовані сполуки (молекули слабких кислот або основ, аніони кислих або катіони основних солей) і змінюється 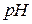 середовища.
середовища.
Щоб зрозуміти суть гідролізу, треба знати, що усі солі є сильними електролітами. Іони основних і кислотних залишків, на які дисоціюють солі, можуть зв’язувати 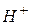 або
або 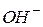 іони води. Внаслідок зв’язування одного з іонів води відбувається зміщення рівноваги процесу дисоціації води вправо і нагромадження в розчині одного з іонів
іони води. Внаслідок зв’язування одного з іонів води відбувається зміщення рівноваги процесу дисоціації води вправо і нагромадження в розчині одного з іонів 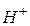 або
або 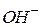 , в результаті чого змінюється
, в результаті чого змінюється 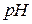 середовища. При цьому необхідно пам’ятати, що з іонів солі можуть зв’язуватися з іонами води тільки ті, які утворюють слабку кислоту або слабку основу. Тому гідролізують солі, до складу яких входить катіон слабкої основи (
середовища. При цьому необхідно пам’ятати, що з іонів солі можуть зв’язуватися з іонами води тільки ті, які утворюють слабку кислоту або слабку основу. Тому гідролізують солі, до складу яких входить катіон слабкої основи (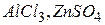 ) або аніон слабкої кислоти (
) або аніон слабкої кислоти (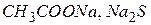 ) або і катіон і аніон одночасно (
) або і катіон і аніон одночасно (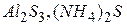 ).
).
Солі, утворені сильною основою і сильною кислотою, не гідролізують, тому що їхні іони не можуть утворити з водою слабких електролітів.
Залежно від типу солі процес гідролізу буде відбуватися по-різному. Розрізняють гідроліз солей: 1) за катіоном (катіон від слабкої основи), 2) за аніоном (аніон від слабкої кислоти), 3) за катіоном і аніоном (обидва від слабких електролітів).
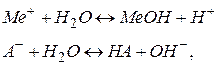
де 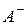 і
і 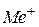 відповідно умовні аніон слабкої кислоти
відповідно умовні аніон слабкої кислоти 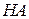 і катіон слабкої основи
і катіон слабкої основи 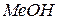 .
.
Солі, утворені багатозарядним катіоном або багатозарядним аніоном, гідролізують ступінчасто. Взаємодія багатозарядних іонів (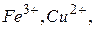
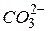
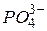 та ін.) з водою, звичайно відбувається до утворення основного або кислого іона (перший ступінь гідролізу), наприклад:
та ін.) з водою, звичайно відбувається до утворення основного або кислого іона (перший ступінь гідролізу), наприклад:
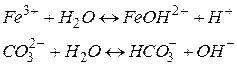
Гідроліз за катіоном призводить до зв’язування гідроксид–іонів води і нагромадження іонів водню, середовище кисле,  .
.
Гідроліз за аніоном призводить до зв’язування іонів водню від води і нагромадження іонів 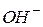 , середовище лужне,
, середовище лужне,  .
.
Необхідно пам’ятати, що гідроліз – процес оборотний і в більшості випадків до кінця не проходить.
Найбільш сильно гідролізують солі, утворені слабкою основою і слабкою кислотою. У цьому випадку реакція гідролізу може практично відбуватися до кінця, необоротно, якщо продукти гідролізу виводяться із сфери реакції, наприклад:
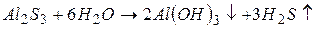
Продуктами гідролізу є слабка основа і слабка кислота, крім того, вони виходять із сфери реакції, зміщуючи тим самим рівновагу гідролізу праворуч.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 331; Нарушение авторских прав?; Мы поможем в написании вашей работы!