
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гліцерин нітрогліцерин
|
|
|
|
План
Тема: Багатоатомні спирти. Будова, номенклатура, ізомерія фенолів та амінів.
Позааудиторна самостійна робота № 16
ІІІ рівень
ІІ рівень
4. Для одноатомних спиртів характерною є наявність:
а) одної гідроксильної групи; в) однієї карбонільної групи;
б) двох гідроксильних груп; г) однієї карбоксильної групи.
5. Вказати карбонільну групу:
а) – ОН; в) – СОН;
б) – С  С -; г) – СООН.
С -; г) – СООН.
6.Встановити відповідність між типом гібридизації та її характеристикою:
1)sp 3 гібридизація а) лінійна молекула, 120 о, 0,12 нм;
2)sp 2 – гібридизація б) площинна молекула, 120 о, 0,143 нм;
3)sp – гібридизація в) тетраедрична молекула, 109,5 о, 0,154 нм;
г) лінійна молекула, 180 о. 0,12 нм;
д) тетраедрична молекула, 120 о. 0,154 нм.
7.Встановити відповідність між класом сполук та особливостями будови їх молекул:
1)алкени а) потрійний зв’язок;
2)алкіни б) гідроксильна група;
3)арени в) ароматичний зв’язок;
4)карбонові кислоти г)карбонільна група;
д) подвійний зв’язок;
е)карбоксильна група.
1. Поняття про багатоатомні спирти, їх ізомерія і номенклатура.
2. Хімічні та фізичні властивості багатоатомних спиртів, їх застосування
3. Будова, номенклатура та ізомерія фенолів.
4. Будова, номенклатура та ізомерія амінів.
Час виконання: 2 години
Мета роботи: систематизувати знання про багатоатомні спирти; розглянути будову, ізомерію та номенклатуру фенолів і амінів.
До складу багатоатомних спиртів входять дві і більше гідроксильних груп. Ці функціональні групи розміщені біля різних атомів Карбону.
За міжнародною номенклатурою для найменування багатоатомних спиртів до суфіксу - ол додають префікс ди -, три - і т. п., який відповідає числу гідроксильних груп, положення яких вказують цифрами.
Для найменування окремих спиртів широко використовуються тривіальні назви:
СН2 – СН2 СН2 – СН – СН2
І І І І І
ОН ОН ОН ОН ОН
1,2 – етандіол 1,2,3 – пропантріол
(етиленгліколь) (гліцерин)
Ізомерія багатоатомних спиртів зумовлена: а) будовою карбонового скелета; б) взаємним розміщенням гідроксильних груп у ланцюгу; в) розміщенням гідроксильних груп у просторі (стереоізомерія).
Фізичні властивості. Багатоатомні спирти – добре розчинні у воді в’язкі рідини або тверді речовини, багато з них солодкі на смак.
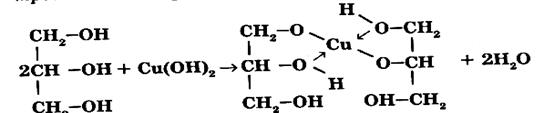
Хімічні властивості. Хімічні властивості багатоатомних спиртів подібні до властивостей одноатомних спиртів. Так, наприклад, вони можуть утворювати алкоголяти, етери і естери; їх гідроксильна група може заміщуватися на атом галогену; вони здатні перетворюватися в ненасичені сполуки, можуть окиснюватися в оксосполуки, які мають альдегідні або кетонні групи, в залежності від положення гідроксильних груп, що окиснюються. Особливістю багатоатомних спиртів є підвищення рухливість атомів Гідрогену гідроксильних груп. Багатоатомні спирти перетворюються в алкоголяти не тільки при взаємодії з натрієм і калієм, але і з гідроксидами важких металів, утворюючи комплексні сполуки:
Дана реакція є якісною реакцією на багатоатомні спирти.
Окремі представники. 1,2 – етиленгліколь СН2ОН – СН2ОН. Це найпростіший і найважливіший представник двоатомних спиртів або гліколів, які одержали цю назву за свій солодкий смак (глікос – солодкий).
Етиленгліколь – це безбарвна, досить густа рідина, що кипить при 197оС.
Ця речовина є важливим продуктом хімічної промисловості. Широко використовуються різноманітні етери і естери етиленгліколю. Діоксан – циклічний етер елетенгліколю, його використовують як розчинник:
Естери етиленгліколю і двоосновних кислот використовуються для виготовлення плівкоутворюючих речовин і синтетичних волокон. Ця речовина використовується у текстильній, косметичній, тютюновій промисловості в якості гігроскопічного матеріалу. Водні розчини етиленгліколю замерзають при температурах нижче нуля (50% - вий розчин при - 37оС), що дає можливість використовувати їх для виготовлення антифризів – рідин, які не замерзають при низьких температурах і використовуються для охолодження автомобільних двигунів.
Сам етиленгліколь діє на організм подібно до етанолу; будучи отруйним, він неодноразово був причиною важких отруєнь.
1,2,3 – Пропантріол (гліцерин) - єдиний практично важливий представник триатомних спиртів. Це сиропоподібна солодка безбарвна рідина, добре розчинна у воді. Водні розчини гліцерину теж замерзають при низьких температурах (67% - вий розчин), тому такі розчини використовуються як антифризи. Гліцерин є основним спиртом, що бере участь у побудові молекул різноманітних ліпідів. В промисловості його добувають при гідролізі жирів та олій. Синтетичним шляхом його добувають з пропілену:
СН2 = СН – СН3 + СІ2  СН2= СН – СНСІ + НСІ
СН2= СН – СНСІ + НСІ
СН2= СН – СНСІ + NaOH  СН2= СН – СНOH + NaСІ
СН2= СН – СНOH + NaСІ
СН2Cl - СНOH – СНOH
СН2= СН – СНOH + HClO 
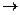 СН2OH - СНCl – СНOH
СН2OH - СНCl – СНOH
СН2Cl - СНOH – СНOH + NaOH 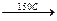 CH2 – CH – CH2
CH2 – CH – CH2
СН2OH - СНCl – СНOH l l l
OH OH OH
Основна маса гліцерину використовується для одержання похідних – гліфталевих смол і нітрогліцерину. Гліфталеві смоли (гліфталі) – поліестери гліцерину і фталевої кислоти – використовуються для виготовлення лаків.
Якісною реакцією на багатоатомні спирти є взаємодія з купрум (ІІ) гідроксидом. При цьому утворюється синій розчин
Гліцериннітрат, або, як його невірно називають в техніці, нітрогліцерин – естер гліцерину і нітратної кислоти:
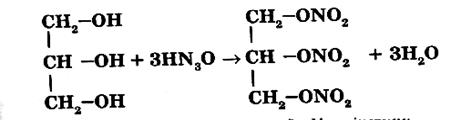
Нітрогліцерин – вибухова речовина великої сили (вибухає від легкого поштовху). Для вибухових робіт часто використовується суміш, яка складається з 75% нітрогліцерину і 25% інфузорної землі, яка називається динамітом.
В фармації гліцерин використовується для пом’якшення шкіри і в якості основи для приготування мазей і паст. Нітрогліцерин (1 %-вий спиртовий розчин) застосовують для лікування приступів грудної жаби (стенокардії), оскільки він розширює коронарні судини.
Представники спиртів, що містять у молекулі п’ять або шість гідроксильних груп,- ксиліт CН2ОН – (СНОН)3 – СН2ОН і сорбіт CН2ОН – (СНОН)4 – СН2ОН. Спиртові гідроксогрупи понижують токсичність сполуки: чим більше гідроксогруп у сполуці, тим менш вона токсична. При накопиченні гідроксогруп у сполуці збільшується її розчинність у воді і зменшується розчинність у неводних розчинниках; тому в ліпоїдах нервової тканини ці речовини не накопичуються і не можуть викликати наркотичний ефект.
Ксиліт і сорбіт використовуються як замінники цукру для хворих діабетом. Із сорбіту виготовляють аскорбінову кислоту (вітамін С).
Фенолами називаються похідні ароматичних вуглеводнів, які містять одну або кілька гідроксильних груп, що заміщують атоми Гідрогену в бензеновому ядрі.
Якщо в молекулі вуглеводню замістити один атом Гідрогену, одержиться одноатомний фенол (С6Н5-ОН).

Якщо в ядрі арену міститься дві гідроксильні групи, то утворюються двоатомні феноли (С6Н4(ОН)2), а при наявності трьох гідроксильних
груп – триатомні феноли (С6Н3(ОН)3). Ізомерія фенолів пов’язана з різним розташуванням гідроксильних груп.
Дві гідроксильні групи в молекулах фенолів можуть перебувати по відношенню одна до одної в орто -, мета - і пара – положенні. У зв’язку з цим існує три найпростіших двоатомні феноли, похідні бензену: о – дигідроксибензен, або пірокатехін, м – дигідроксибензен, або резорцин, і п – дигідроксибензен, або гідрохінон:

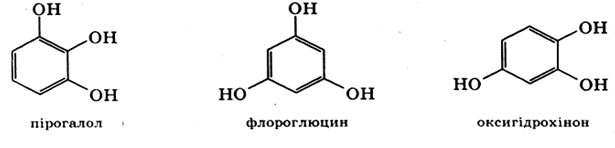
Існує три ізомери триатомних фенолів – похідних бензену: з рядовим, симетричним і несиметричним розташуванням гідроксильних груп. Рядовий тригідроксибензен називається пірогалол, симетричний тригідроксибензен – флороглюцин.
Окремі представники. Фенол (гідроксибензен, карболова кислота) – безбарвна кристалічна речовина з характерним різким запахом, на повітрі набуває червонувато – коричневого забарвлення внаслідок окиснення, отруйний, при потраплянні на шкіру викликає опіки. Водний розчин використовують як антисептик (останнім часом - тільки у ветеринарній медицині). Фенол є одним з найважливіших продуктів хімічної промисловості. Він використовується для добування барвників, пластмас, лікарських препаратів, ароматизуючи речовин тощо. Легка окиснюваність фенолів дала змогу використовувати їх як антиоксиданти для захисту від окиснення вуглеводнів, оксосполук, жирів. Антиоксиданти фенольної природи широко використовують у харчовій промисловості для зберігання жирів, молочних та кондитерських виробів, м ясних та рибних продуктів, а також для стабілізації бензинів, сповільнення старіння каучуків.
Піокатехін міститься у багатьох рослинах (наприклад у смолі букового дерева), має сильний характерний запах і застосовується в медицині для лікування захворювань дихальних шляхів і туберкульозу. Пірокатехін використовують як проявник у фотографії, а також для добування адреналіну.
Резорцин та його похідні використовуються для виготовлення барвників, пластмас, як антисептики, а також для лікування екзем, сечового міхура, а 1,3 – дигідрокси – 4 – гексилбензен – як антигельмінтний препарат.
Гідрохінон є чудовим відновником, тому використовується як проявник у фотографії, а також як інгібітор полімеризації ненасичених сполук.
Флороглюцин використовується для визначення хлоридної кислоти у шлунковому соку.
Амінами називаються органічні сполуки, що містять в молекулі групу -NH2 (аміногрупу). Аміни можна розглядати і як похідні амоніаку, в молекулі якого атоми Гідрогену заміщені на вуглеводневі радикали.

Мал. 35. Кулестержневі моделі молекул амоніаку і метиламіну
Класифікація. 1. Залежно від того, скільки атомів Гідрогену заміщено на вуглеводневі залишки (скільки залишків сполучено з атомом Нітрогену), розрізняють первинні, вторинні та третинні аміни.
Однозаміщені похідні амоніаку називаються первинними, двозаміщені – вторинними, тризаміщені – третинними амінами:

2. Залежно від типу залишку розрізняють аліфатичні (насичені і ненасичені), аліциклічні, ароматичні, гетероциклічні аміни.
3. Залежно від кількості аміногруп -NH2 розрізняють моноаміни, діаміни тощо.
За систематичною номенклатурою аміни розглядають як алкілпохідні амоніаку; їх назву складають з двох частин: назви радикалу і суфікса -амін з позначенням номера атома Карбону, зв’язаного з аміногрупою:
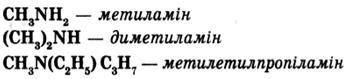
Ізомерія амінів визначається кількістю і будовою радикалів, а також положенням аміногрупи:
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2922; Нарушение авторских прав?; Мы поможем в написании вашей работы!