
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисно-відновні реакції
|
|
|
|
Всі хімічні реакції в залежності від сталості або зміни ступенів окиснення атомів реагуючих речовин можна поділити на два типи: 1) реакції без зміни ступенів окиснення атомів реагуючих речовин; 2) реакції, які супроводжуються зміною ступенів окиснення атомів реагуючих речовин.
До першого типу належать:
а) реакції обміну:  ;
;
б) деякі реакції з’єднання: 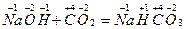 ;
;
в) деякі реакції розкладу: 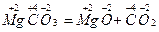 .
.
Реакції другого типу називають окисно-відновними.
Окисно-відновні процеси належать до найбільш поширених хімічних реакцій.
Людство давно користувалось окисно-відновними реакціями, спочатку не розуміючи їх сутність.
Тільки в ХVII-ХVIII ст. були зроблені спроби узагальнити одержані результати і створити теорію окисно-відновних реакцій.
В кінці ХVIII ст. з’являється киснева теорія, у відповідності з якою окиснення – це процес сполучення речовини з киснем (2Cu + O2 = 2 CuO), а відновлення – втрата кисню (CuO + H2 = Cu + H2O).
В кінці ХІХ ст. на зміну кисневій теорії прийшла електронна теорія окисно-відновних реакцій, в розробці і поширенні якої брали участь Л.Пісаржевський, Я.Михайленко, А.Беркенгейм та інші вчені.
Сучасна теорія окисно-відновних процесів заснована на таких основних положеннях: окиснення – це втрата електронів, що супроводжується підвищенням ступеня окиснення елемента; відновлення – це приєднання електронів, що супроводжується зниженням ступеня окиснення елемента; окисник – це речовина, атоми або йони якої в процесі хімічної реакції приєднують електрони; відновник – це речовина, атоми або йони якої віддають електрони.
Розглянемо реакцію взаємодії міді з киснем:  .
.
Мідь, втрачаючи електрони, окиснюється і є відновником. Кисень, приймаючи електрони, відновлюється і є окисником:
відновник -  - окиснення;
- окиснення;
окисник - 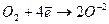 - відновлення.
- відновлення.
Загальне число електронів в системі під час хімічних реакцій не змінюється: число електронів, що віддаються молекулами, атомами або йонами відновника дорівнює числу електронів, які приєднуються молекулами, атомами або йонами окисника.
Потенціал йонізації може бути мірою відновлювальної активності атомів елементів.
Із зменшенням потенціалу йонізації посилюються відновні властивості атомів елементів.
Спорідненість до електрону – це міра окисної здатності атомів. Із збільшенням спорідненості до електрона посилюються окисні властивості атомів елементів.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 607; Нарушение авторских прав?; Мы поможем в написании вашей работы!