
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ряд стандартних електродних потенціалів металів
|
|
|
|
Всi електроднi процеси, якi виражаються рівнянням  L
L 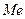 , прийнято розмiщувати за величиною їхніх стандартних потенціалiв в ряд, який називають рядом стандартних електродних потенціалів (рядом напруг, табл.13).
, прийнято розмiщувати за величиною їхніх стандартних потенціалiв в ряд, який називають рядом стандартних електродних потенціалів (рядом напруг, табл.13).
Цей ряд характеризує окисно-вiдновну здатнiсть електрохiмiчної системи „метал - йон металу” за певних умов: наведенi в ньому величини вiдносяться до водного розчину з температурою 250 С i концентрацією йонiв металу 1 моль/л. В цей ряд завжди розмiщують i водень, що дає змогу бачити, якi метали витiсняють водень з кислот.
Йони металiв - окисники, а метали у виглядi простих речовин - вiдновники. Чим більша алгебраїчна величина стандартного електродного потенціалу металу, тим сильнiшим окисником в водному розчинi є його йони; чим менша алгебраїчна величина потенціалу, тим сильніше виражені вiдновнi властивостi простої речовини - металу.
Таблиця 13
Ряд стандартних електродних потенціалів металів
| Рівняння електродного процесу | Стандартний потенціал φ0 при 250С, В | Рівняння електродного процесу | Стандартний потенціал φ0 при 250С, В |
| Li+ + e = Li | -3,045 | Co2+ + 2e = Co | -0,277 |
| Rb+ + e = Rb | -2,925 | Ni2+ + 2e = Ni | -0,250 |
| K+ + e = K | -2,924 | Sn2+ + 2e = Sn | -0,136 |
| Cs+ + e = Cs | -2,923 | Pb2+ + 2e = Pb | -0,126 |
| Ca2+ + 2e = Ca | -2,866 | Fe3+ + 3e = Fe | -0,037 |
| Na+ + e = Na | -2,714 | 2H+ + 2e = H2 | |
| Mg2+ + 2e = Mg | -2,363 | Bi3+ + 3e = Bi | 0,215 |
| Al3+ + 2e = Al | -1,663 | Cu2+ + 2e = Cu | 0,337 |
| Ti2+ + 2e = Ti | -1,630 | Cu+ + e = Cu | 0,520 |
| Mn2+ + 2e = Mn | -1,179 | Hg22+ + 2e = 2Hg | 0,789 |
| Cr2+ + 2e = Cr | -0,913 | Ag+ + e = Ag | 0,799 |
| Zn2+ + 2e = Zn | -0,763 | Hg2+ + 2e = Hg | 0,850 |
| Cr3+ + 3e = Cr | -0,744 | Pt2+ + 2e = Pt | 1,188 |
| Fe2+ + 2e = Fe | -0,440 | Au3+ + 3e = Au | 1,498 |
| Cd2+ + 2e = Cd | -0,403 | Au+ + e = Au | 1,692 |
Потенцiал електродного процесу 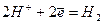 в нейтральному середовищi дорівнює:
в нейтральному середовищi дорівнює:
 .
.
Активнi метали початку ряду (до Мg) витiсняють водень з води, Мg - тiльки з гарячої. Метали мiж Мg i Cd не витiсняють водень з води, хоча теоретично мають витісняти. На поверхнi цих металiв утворюються оксиднi плiвки.
Метали мiж Мg i воднем витiсняють водень з розчинiв кислот. При цьому на поверхнi деяких металiв утворюються захиснi плiвки.
Метали можуть витiсняти один одного з розчинiв солей.
Напрямок реакцiї визначається їх взаємним положенням в рядi стандартних електродних потенціалів. Завжди електрохiмiчна система з бiльш високим значенням електродного потенцiалу виступає як окисник.
Активні метали витісняють водень не тільки з води, але й з будь-яких водних розчинів, тому взаємне витіснення металів з розчинів солей відбувається лише у випадку металів, розташованих після магнію.
Взаємне положення деяких металів в ряді стандартних електродних потенціалів і в періодичній системі не співпадають (Li, Na, K; Zn і Cu).
Причина полягає в тому, що в періодичній системі мірою хімічної активності є величина енергії йонізації вільних атомів; в ряді ж стандартних електродних потенціалів – робота перетворення металу, що знаходиться в твердому стані, в гідратований йон у водному розчині. Ця робота – сума трьох доданків: енергії атомізації – перетворення кристала в ізольовані атоми, енергії йонізації і енергії гідратації йонів, що утворились. Енергія атомізації характеризує міцність кристалічної гратки. Енергія йонізації визначається розміщенням металу в періодичній системі. Енергія гідратації залежить від заряду йона і його радіусу. Поле поблизу маленьких йонів Літію сильніше, ніж поблизу великих йонів Калію, йони Lі+ будуть гідратуватися з виділенням більшої енергії, ніж йони К+. Чим менша сумарна затрата енергії, тим ближче до початку ряду розміщується метал. Так, для Літію вона виявилась меншою, ніж для Калію.
У випадку міді і цинку затрати енергії на йонізацію і виграш при гідратації близькі, але у міді більш міцна кристалічна гратка, тому цинк розташувався значно ближче до початку ряду.
В неводних розчинах розташування металів може змінюватись, тому що енергія сольватації металів при переході від одного розчинника до іншого змінюється по-різному.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 4683; Нарушение авторских прав?; Мы поможем в написании вашей работы!