
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електроліз
|
|
|
|
Електроліз – це окисно-відновний процес, який відбувається при пропусканні постійного електричного струму через розчин або розплав електроліту. При цьому електрична енергія перетворюється в хімічну.
Електрод, на якому відбувається реакція відновлення, називається катодом. Він підключений до від’ємного полюсу зовнішнього джерела струму.
Електрод, на якому відбувається реакція окиснення, називається анодом. Він підключений до додатного полюсу джерела струму.
Розглянемо, які реакції відбуваються при електролізі розплаву натрій хлориду (рис.35). В розплаві натрій хлориду є йони Na+ і йони C1-. Якщо занурити в розплавлену сіль два графітових електроди і підключити їх до полюсів зовнішнього джерела струму, то в електроліті почнеться напрямлений рух йонів і на електродах будуть відбуватись такі реакції: а) відновлення йонів Nа+ до металічного натрію на від’ємному електроді, тобто електроді, на який надходять електрони від зовнішнього джерела струму:
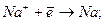
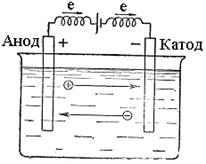
Рис. 35. Схема електролізу
б) окиснення йонів С1- до газоподібного хлору на додатному електроді, з якого електрони йдуть в зовнішнє коло: 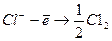 . Сумарна реакція:
. Сумарна реакція: 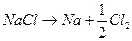 .
.
В розглянутому прикладі в електроліті був один вид катіонів і один вид аніонів, тому інших варіантів катодного і анодного процесів не було.
Але, якщо електролізу підлягають водні розчини солей, то окрім катіонів і аніонів солі завжди є йони Н+ і ОН-, які утворюються при дисоціації води: 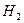 L
L 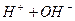 .
.
При наявності декількох видів йонів є можливим перебіг декількох електродних реакцій.
В зв’язку з тим, що на катоді відбувається реакція відновлення, тобто приєднання електронів окисником, то в першу чергу повинні відновлюватись найбільш сильні окисники.
Вже відомо, що чим менша алгебраїчна величина стандартного електродного потенціалу, тим слабшою є окисна здатність його йонів, тобто здатність приєднувати електрони, тому на катоді перш за все відновлюється окиснена форма тої електрохімічної системи, якій відповідає найбільше значення електродного потенціалу.
Стандартний електродний потенціал водневого електрода дорівнює нулю при концентрації йонів Н+, що дорівнює 1 моль/л, тобто при рН =0. Із збільшенням рН потенціал водневого електрода стає від’ємним, а при рН=7 ([H+] = 10-7 моль/л) він дорівнює:
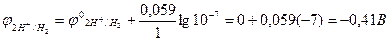 .
.
Отже, при пропусканні електричного струму через водні розчини солей металів, стандартні електродні потенціали яких менші за –0,41В, теоретично на катоді мають відновлюватись не йони металів, а йони Н+ з Н2О.
Однак молекули води відновлюються тільки при електролізі водних розчинів солей найбільш активних металів, розташованих в ряді стандартних електродних потенціалів до алюмінію включно. Пояснюється це явищем перенапруги – для відновлення води необхідно прикласти надлишкову електрорушійну силу. В результаті цього досягається значення потенціалу, при якому може відбуватись електроліз солі металу, електродний потенціал якого менший за –0,41В.
Процеси, які відбуваються на аноді, залежать як від електроліту, так і від речовини, з якої виготовлений анод.
Розрізняють два види анодів – розчинні і нерозчинні (інертні). Нерозчинні аноди виготовляють з золота, платини або графіту. На поверхні таких анодів відбувається окиснення кислотних залишків або молекул води.
При значній концентрації електроліту легко окиснюються йони безоксигенових кислот: Cl-, Br-, I-, S2-. Аніони оксигеновмісних кислот або не здатні окиснюватись або окиснюються при дуже високих потенціалах. В цьому випадку на аноді окиснюються молекули води.
Розглянемо декілька типових випадків електролізу водних розчинів солей.
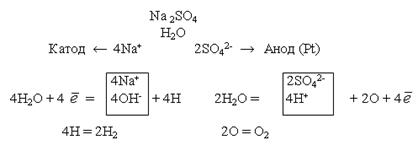
Електроліз розчину Na2SO4 з інертним анодом. Стандартний електродний потенціал системи 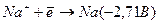 більш негативний, ніж потенціал водневого електрода в нейтральному водному середовищі (-0,41В). Тому на катоді буде відбуватись електрохімічне відновлення води з виділенням водню
більш негативний, ніж потенціал водневого електрода в нейтральному водному середовищі (-0,41В). Тому на катоді буде відбуватись електрохімічне відновлення води з виділенням водню
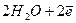 L
L 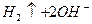 ,
,
а йони Na+, які підійшли до катоду, будуть накопичуватись в катодному просторі і там утвориться натрій гідроксид.
На аноді буде відбуватись електрохімічне окиснення води, яке супроводжується виділенням кисню
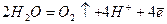 .
.
Оскільки електродний потенціал цієї системи (1,23В) значно нижчий за стандартний електродний потенціал системи
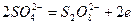 (2,01В)
(2,01В)
йони SO42- будуть накопичуватись в анодному просторі і там утвориться сульфатна кислота.
Схема електролізу розчину натрій сульфату:
Cумарне рівняння цього процесу можна записати в такій формі:





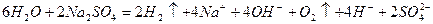
 біля катоду біля аноду
біля катоду біля аноду
Електроліз розчину CuC12 з інертним анодом. Мідь у ряді стандартних електродних потенціалів розміщена після водню. Тому біля катода буде відбуватись розрядження йонів Сu2+ і виділення металічної міді. Біля анода будуть розряджатись йони С1-.
Схема електролізу розчину купрум(ІІ) хлориду:
| CuCl2 | ||
| Катод (C) ← Cu2+ | 2Cl- → Анод (C) | |
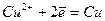
| 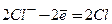
|
Сумарне рівняння: CuCl2 → Cu + Cl2.
У випадку активного (розчинного) анода число конкуруючих окисних процесів зростає до трьох: електрохімічне окиснення води з виділенням кисню, окиснення аніона і електрохімічне окиснення металу анода (анодне розчинення металу). З цих можливих процесів буде відбуватись той, який енергетично найвигідніший. Якщо алгебраїчна величина електродного потенціалу металу анода менша за алгебраїчну величину потенціалів інших електрохімічних систем, то спостерігається анодне розчинення металу. В інших випадках відбувається виділення кисню або окиснення аніона.
Розглянемо електроліз розчину CuSO4 з анодом з міді.
На катоді можуть відновлюватись йони Сu2+ і йони H+ з води. Однак Cu2+ відновлюється легше, ніж Н+, тому що стандартний електродний потенціал міді більший за стандартний електродний потенціал водню. На катоді буде відбуватись процес:
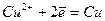 .
.
На аноді буде окиснюватись мідь, тому що алгебраїчна величина її електродного потенціалу менша за алгебраїчну величину потенціалів інших конкуруючих електрохімічних систем:

Отже, при електролізі розчину купрум(ІІ) сульфату розчиняється анод і відбувається осадження міді на катоді.
Схематично процес електролізу виразиться так:
| CuSO4 | ||
| Катод (Сu) | ← Cu2+ + SO42- → | Анод (Cu) |
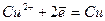
| 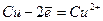
|
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2331; Нарушение авторских прав?; Мы поможем в написании вашей работы!