
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ідентифікація невідомої органічної речовини
|
|
|
|
1. Опис зовнішнього вигляду речовини:
а) агрегатний стан — для твердих речовин відзначають стан (кристалічний чи аморфний) і форму кристалів (призми, пластинки, голки тощо);б) колір;в) запах.На смак речовину не пробувати!
2. Спалювання речовини.
При дослідженні органічної речовини, склад якої невідомий, необхідно насамперед з'ясувати, чи не містить ця речовина неорганічні фрагменти.
Якщо проба являє собою органічну речовину, то при спалюванні вона спочатку обвуглюється, а при подальшому, більш сильному, нагріванні або прожарюванні цілком згоряє. Якщо ж проба містить неорганічні речовини, то залишається неспалений залишок (зола).
II. Проведення якісного елементного аналізу.
1. Виявлення карбону і гідрогену методом спалювання речовини з купруму (II) оксидом.
2. Виявлення нітрогену, сульфуру і галогенів методом сплавлення речовини з металічним натрієм.
3. Виявлення оксигену.
III. Визначення розчинності у воді, розчинах лугів і кислот.
Примітка: для сполук, розчинних у лугах, насамперед необхідно провести реакцію з феруму (III) хлоридом, індофенолову реакцію
5.2. Схема дослідження невідомої органічної сполуки
і реакцію з нінгідрином. Якщо реакція з нінгідрином позитивна, то проводять реакції з формаліном, а потім з метиловим червоним (спосіб виявлення а-амінокислот).
Для сполук, розчинних у кислотах, насамперед проводять ізо-нітрильну реакцію, реакцію з нітритною кислотою й одержання азобарвника.
IV. Проба на лакмус.
V. Визначення функціональних груп.
1. Кратні зв'язки:
а) знебарвлення бромної води (у деяких випадках використовують розчин брому в тетрахлорометані);
б) реакція з калію перманганатом;
Примітка: розчин калію перманганату може окиснювати спиртовий гідроксил і альдегідну групу, тому до проведення цієї реакції вищезгадані групи треба попередньо захистити.
в) утворення ацетиленідів (реакція з амоніачним розчином купруму (I) хлориду або амоніачним розчином аргенту-му оксиду).
2. Ароматичні вуглеводні:
а) реакція нітрування;
б) реакція сульфування.
3. Нітрогрупа:
а) реакція з цинком і амонію хлоридом;б) реакція з натрію гідроксидом
Вопрос№4
Нітросполуки.Будова нітрогрупи. Одержання нітросполук. Хімічні і фізичні властивості нітросполук.
Нітросполуки-це органічні речовини, в молекулах яких є нітрогрупа -NO2, пов'язана з атомамивуглецю.
Будова нітрогрупи:
Нітрогрупа має плоску (планарну будову); атоми нітрогену та оксигену знаходяться в стані sp 2-гібридизації. Електронна будова може бути представлена у вигляді двох граничних структур, в яких один з атомів оксигену утворює з атомом нітрогену подвійний, а другий — семіполярний зв’язок.
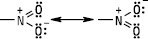
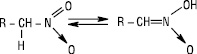
Залежно від природи вуглеводневого радикалу, з яким зв’язана нітрогрупа, розрізняють аліфатичні та ароматичні Н. За розміщенням нітрогрупи у вуглецевому ланцюгу Н. підрозділяють на первинні, вторинні й третинні. Назви Н. утворюють додаванням префікса нітро- до назви відповідного вуглеводню із зазначенням положення нітрогрупи у вуглецевому ланцюгу: CH3CH(NO2)CH2CH3 — 2‑нітробутан, C6H5NO2 — нітробензен, C6H5CH2CH2NO2 — 1-нітро-2-фенілметан. Аліфатичні Н. — безбарвні рідини, які мають приємний запах і переганяються без розкладання, мало розчиняються у воді, токсичні, не викликають корозії металів, їх водні розчини мають нейтральну реакцію, Tкип вища, ніж у спиртів або карбонільних сполук. Ароматичні мононітросполуки — висококиплячі рідини або тверді низькоплавкі речовини, безбарвні або світло-жовтого кольору, важчі за воду і в ній не розчиняються, мають запах гіркого мигдалю. Н., які містять рухливі атоми гідрогену біля атома карбону, є таутомерними сполуками (нітро-ацинітротаутометрія):
Одержання нітросполук:
Отримання
Нітрування алканів (Коновалов, Хесс). Алкани окислюються концентрованої азотної кислотою або сумішшю азотної та сірчаної кислот. Нітрування протікає тільки під дією розбавленої азотної кислоти пр нагріванні (М. І. Коновалов, 1888 р.): R-H + HO-NO2 R-NO2 + H2O Швидкість реакції невелика і виходи низькі
. Кращі результати виходять з алканами, що містять третинні вуглецеві атоми. Реакція супроводжується утворенням полінітросполук і окисними процесами. Практичне значення набули такі методи нітрування алканів: 1) в газовій фазі при 350-400 о С за допомогою 40-70% - іншої HNO3 (Нітрування по Хессу, 1936 р.),
2) в рідкій фазі при 100-200оС з 50-70% - іншої HNO3;
3) у рідкій або газовій фазі тетраоксидом або діоксидом азоту. У промисловості набуло застосування нітрування парами азотної кислоти при 250-500оС - парофазного нітрування. Вибір температури процесу залежить від дині вуглецевого ланцюга і будови вуглеводню: ізобутан реагує вже при 150оС, тоді як метан - при 3700С. Реакція супроводжується крекінгом вуглеводню, в результаті чого утворюються мононітроалкани з вуглецевим ланцюгом різної довжини (деструктивне нітрування). На реакцію нітрування витрачається близько 40% азотної кислоти, інша її частина діє як окислювач. Тому поряд з нітросполуками утворюються також спирти, кетони та кислоти. Крім того, утворюються і неграничні вуглеводні. Реакція нітрування - радикальний процес. Ланка ланцюга: RH + NO2 · R · R + NO2 R - NO2
Реакція Мейєра. CH3CH2Br + NaNO2 CH 3 CH 2 NO 2 + NaBr реакція Корнблюм Окислення амінів. Ніросполуки також можуть бути отримані окислюванням амінів: RСH2CH2NH2 RCH2CH2NO2 Алкілювання нітриту аргентуму. В. Мейєр 1872 р. розробив метод одержання нітроалканів при взаємодії галогеиалкілу з нітритом аргентуму:
CH3Br + AgNO2 CH 3 NO 2 + AgBr реакція Мейєра
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 830; Нарушение авторских прав?; Мы поможем в написании вашей работы!