
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика виконання роботи. Самостійна робота на занятті
|
|
|
|
Самостійна робота на занятті.
Контрольні питання.
Заняття 15
Тема: Кінетика біохімічних реакцій.
Актуальність теми: Вивчення кінетики і механізму хімічних реакцій має велике теоретичне і практичне значення як для хімії, так і для медицини. Знання факторів, від яких залежить швидкість реакції дозволить регулювати процеси, які проходять в організмі, вивчати ефективність дії лікарських препаратів. Знання умов протікання реакцій дозволяє регулювати, створювати оптимальні умови протікання реакцій.
Навчальні цілі:
Знати: вплив основних факторів: концентрації, температури, тиску на швидкість та напрям протікання реакцій.
Вміти:. Визначати швидкість хімічної реакції, її залежність від концентрації і вплив каталізаторів.
Самостійна позааудиторна робота студентів.
1. Швидкість хімічних реакцій, її вираження.
2. Вплив природи реагуючих речовин, концентрації на швидкість реакції.
3. Закон діючих мас.Фізичний зміст константи хімічної рівноваги, її вираз.
4. Константа хімічної рівноваги, способи її вираження.
5. Порядок і молекулярність хімічних реакцій.
6. Енергія активації. Каталіз і каталізатори.
7. Залежність швидкості реакції від температури і тиску.
8. Ферментативні біохімічні процеси. Ферменти, як біологічні каталізатори.
9. Ланцюгові та фотохімічні, біохімічні реакції.
10. Прогнозування зміщення хімічної рівноваги на основі принципу Ле-Шательє-Брауна-Пригожина.
1. Напишіть вираз:
а) константи рівноваги;
б) швидкості прямої і зворотної реакції.
Для реакцій:
СО2(г) + С(тв) =СО (г) N2 + O2 = 2NO
N2 + 3H2 = 2NH3 CO(г) + H2O(г) = CO2(г) + H2
2SО2(г) + О2(г) = 2SО3 (г) 2NO2 = 2NO +O2
2NO + Cl2 =2NOCl 2СО + О2 = 2СО2
2Н2 + О2 = 2H2O(г) 2NO + О2 = 2NO2
С(тв) + Н2О (г) = СО + Н2 2N2O + O2 = 4NO
2. Як зміниться швидкість даної реакції, якщо:
а) концентрацію одногозкомпонентівзбільшити в два рази;
б) тиск системи зменшити в три рази;
в) температуру підвищити з 650 до 720 К (температурний коефіцієнт 2).
Виконати лабораторні роботи.
1. Визначення залежності швидкості хімічної реакції від концентрації
2. Визначення залежності швидкості хімічної реакції від каталізатора.
Робота 1. Залежність швидкості реакції від концентрації реагуючих речовин.
В 5 пробірок послідовно налити по 0,5; 1,0; 1,5; 2,0; 2,5 мл 0,1 М розчину тіосульфату натрію. В кожну з перших чотирьох пробірок відповідно долити 2,0; 1,5,; 1,0; 0,5 мл води, а п’ята пробірка залишається без змін. Ці п’ять вихідних розчинів умовно назвемо розчини 1. Окремо в 5 інших пробірок наливають по 2,5 мл 0,1 М розчину сірчаної кислоти. Попарно зливають розчини в 1 і 2. Визначають час до початку помутніння розчину в кожній пробірці. Результати спостережень записують в таблицю.
| № п/п | Об’єм в мл | Концентрація вихідного Na2S2O3 | Час помутніння | ||
| H2SO4 | H2O | Na2S2O3 | |||
| 0,5 | 2,0 | 0,5 | |||
| 0,5 | 1,5 | 1,0 | |||
| 0,5 | 1,0 | 1,5 | |||
| 0,5 | 0,5 | ||||
| 2,5 |
За результатами досліду розраховують концентрації одержаних вихідних розчинів тіосульфату натрію в кожній з пробірок за формулою. Малюють графік залежності в координатах: концентрації тіосульфату – час помутніння. На основі цього зробити висновок залежності швидкості реакції від концентрації тіосульфату натрію.
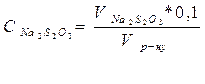
Робота 2. Залежність швидкості реакції від наявності каталізатора.
В дві пробірки окремо наливають по 2 мл 0,1 М розчину тіосульфату натрію, в інші дві пробірки – по 2,5 мл 0,5 М розчину сірчаної кислоти. В одну із пробірок з тіосульфатом натрію приливають 0,5 мл, 0,05 М розчину сульфату міді (каталізатор), а в другу – 0,5 мл води.
Розчини попарно зливають і спостерігають за часом помутніння в кожній пробірці. Вказати дію каталізатора (прискорює чи сповільнює дану реакцію).
Заняття №15
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 337; Нарушение авторских прав?; Мы поможем в написании вашей работы!