
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика виконання роботи. Самостійна робота на занятті
|
|
|
|
Самостійна робота на занятті.
Виконати лабораторні роботи:
1. Визначити константу електродної посудини.
2. Визначити електропровідність розчинів слабих електролітів.
3. Визначити ступінь і константу дисоціації досліджуваних електролітів
Робота 1. Визначення константи електродної посудини.
Визначення константи електродної посудини проводять за допомогою розчину електроліту, для якого відоме значення питомої електропровідності. З цією метою використовують, як правило, 0,01 М розчин Ксl, для якого при 20 0С 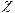 = 1,25 × 10-3 См/м.
= 1,25 × 10-3 См/м.
В посудину для визначення електропровідності наливають такий об’єм 0,01 М розчину Ксl, щоб електроди були повністю занурені в розчин. За допомогою омметра замірюють опір розчину в посудині і за формулою К = R× 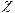 вираховують її константу.
вираховують її константу.
Робота 2. Визначення електропровідності розчинів слабих електролітів та біологічних рідин.
Визначивши постійну (константу) електродної посудини, останню старанно промивають дистильованою водою, наливають в неї відповідний досліджуваний розчин слабкого електроліту і вимірюють опір. Одержані дані заносять у таблицю:
| № п/п | Досліджуваний розчин | R | 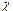
| 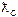
| 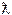 
|
| 1 | 0,1 М НСООН | ||||
| 2. | 0,1 М СН3 СООН | ||||
| 3. | 0,1 М ССl3 COOH | ||||
| 4. | 0,1 М NH4 OH | ||||
| 5. | Шлунковий сік (1:10) | - | |||
| 6. | Сироватка крові (1:5) | - |
Використовуючи знайдені величини опору досліджуваних розчинів і постійну електродної посудини (K) розраховують питому електропровідність:
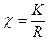
і молярну електропровідність:
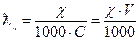 де:
де:  - питома електропровідність
- питома електропровідність
С - молярна концентрація
V – розведення, 
Для розчинів слабких електролітів розрахувати також граничну молярну електричну провідність, використовуючи дані довідника про електролітичну рухливість відповідних іонів:
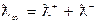
Результати занести в таблицю і зробити висновок.
Робота 3 .Порівняння сили електролітів на основі електропровідності їх розчинів.
Використовуючи дані із роботи № 2 про молярну електропровідність і граничну електропровідність відповідних розчинів електролітів, розраховують ступінь і константу дисоціації.
 ; К=
; К= 
Дані занести у таблицю і зробити висновок про силу різних електролітів і як впливає введення хлору в радикал кислоти на її силу.
| № п/п | Досліджуваний розчин |  a a
| К |
| 1 | 0,1 М НСНОН | ||
| 2. | 0,1 М СН3 СООН | ||
| 3. | 0,1 М ССl3 COOH | ||
| 4. | 0,1 М NH4 OH |
Заняття №16
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 353; Нарушение авторских прав?; Мы поможем в написании вашей работы!