
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Білет 10. Загальний аналіз процесів у друкарських та після друкарських операціях виготовлення друкових видань та пакувань
|
|
|
|
Загальний аналіз процесів у друкарських та після друкарських операціях виготовлення друкових видань та пакувань.
Білет 9
1)Ідеальні гази та ідеальні розчини.Концентрація та активність.Тиск і фугітивність. Електроліти і неелектроліти. Дисоціація (електролітична).Ph.Вода.Йонний добуток води.Жорсткість(твердість води).DH.
2)
- Термодинаміка, основні відомості. Початки термодинаміки. Енергія, ентропія. Впорядковані та невпорядковані системи. Інформація та ентропія. Ентропійні аспекти технологій і соціальних і економічних явищ.
Термодинаміка – розділ, який вивчає енергетичні характеристики різних речовин або систем і перетворювання енергії різних процесів.
Основні поняття і визначення термодинаміки:
Термодинамічна система – тіло або сукупність тіл, що перебувають у взаємодії та відокремлені від довкілля уявною або реальною поверхнею поділу.
Параметри термодинамічної системи:
Стан системи визначається сукупністю властивостей: інтенсивність(залежить від розмірів системи), екстенсивні(не залежать від розмірів системи). Сукупність термодинамічних властивостей визначає термодинамічний стан системи.
Енергія є мірою руху.Повна енергія=Ек+Еп і внутрішня (U)-загальний запас енергыъ,що складається з кінетичної енергії руху її складових частин та потенціальної енергії їхньої взаємодії без урахування потенціальної енергії системи.
Ентропія – міра знеціненої енергії.
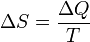
Зв'язок між теплоємністю та ентропією дається формулою
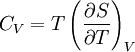
Інформаційна ентропія - міра невизначеності або непередбачуваності інформації,невизначеність появи будьякого символу первинногоалфавіту. При відсутності інформаційних втрат чисельно дорівнюєкількості інформації на символ переданого повідомлення.
- Закон Ньютона. Рідини, що підпорядковуються цьому закону(ньютонівські рідини) та ті, що не підпорядковуються йому (неньютонівські рідини).
F=ŋ dv/dy – рівняння, що описує поведінку ньютонівської рідини.
ŋ – коефіцієнт в’язкості
Ньютонівська рідина - в'язка рідина, що підкоряється при своїй течії закону в'язкого тертя Ньютона. Прикладом ньютонівської рідини є вода, вона продовжуєдемонструвати властивості рідини незалежно від швидкостіперемішування, на противагу неньютонівських рідин, в'язкість яких змінюється в залежності від швидкості току рідини - наприклад, перемішування може залишати «дірку» позаду (яка потроху заповнюється згодом - така поведінка спостерігається в таких речовинах, як пудинг, суспензія крохмалю в холодній воді і, в менш суворих рамках пісок), а при зменшенні товщини шару рідинивідбувається стрибок в'язкості череззміну швидкості течії рідини (цеспостерігається у деяких неподтекающіх фарб, які легко наносяться,але стають більш в'язкими на стінах).
- Хімічна кінетика. Молекулярність і порядок реації. Визначення порядку реакції.
Хімічна кінетика — розділ хімії, що вивчає швидкість хімічних процесів. Ця наука включає в себе вивчення впливу різних експериментальних умов на швидкість хімічних реакцій та досліджує їх механізми. Існує формальна (закон дії мас) і молекулярна(елементарні реакції) кінетика.
Закон діючих мас встановлює співвідношення між масами реагуючих речовин в хімічних реакціях при рівновазі, а також залежність швидкості хімічної реакції від концентрації вихідних речовин.
Молекулярність реакції — число частинок реагентів, що взаємодіють один з одним в одній елементарній (простій) реакції та перетворюються в продукти. Реакції бувають одномолекулярні і бімолекулярні (не існує 3-молекулярних реакцій)
H+O2àH2O+O0 – бімолекулярна реакція
Порядок реакції – показник степеня при концентрації цієї речовини в кінетичному рівнянні реакції. Порядок реакції визначається сумою показників ступеня в речовині закону дії мас
Згідно закону мас швидкість реакціі між А і В: kCAnA CBnB.
СА і Св-концентрації реагентів А і В, k - константа швидкості р-ції, nА і nВ-порядки реакції по реагенам А і В свідповідно, П = nА + nв-загальний порядок реакції. Реакціїї можуть бути 0,1,2,3 порядку
A+BàAB
4Al+3O2à 2Al2O3
V= kCACB
V=KCAl11Co23
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 556; Нарушение авторских прав?; Мы поможем в написании вашей работы!