
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Енергія Гіббса і напрям ходу реакції
|
|
|
|
Історична довідка
Визначення
Класичним визначенням енергії Гіббса є вираз
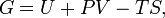
де U - внутрішня енергія, P - тиск, V - об'єм, T - абсолютна температура, S - ентропія.
Диференціал енергії Гіббса для системи з постійним числом частинок, виражений у власних змінних - через тиск p і температуру T:
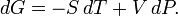
Для системи із змінним числом частинок цей диференціал записується так:
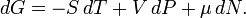
Тут μ - хімічний потенціал, який можна визначити як енергію, яку необхідно затратити, щоб додати в систему ще одну частку.
Енергія Гіббса названа на честь одного із засновників термодинаміки, Джозайя Уілларда Гіббса.
У хімічних процесах одночасно діють два протилежні фактори - ентропійний (T Δ S) і ентальпійний (Δ H). Сумарний ефект цих протилежних факторів у процесах, що перебігають при постійному тиску і температурі, визначає зміна енергії Гіббса (G):
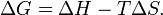
З цього виразу випливає, що 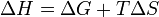 , тобто деяка кількість теплоти витрачається на збільшенні ентропії (T Δ S), ця частина енергії втрачена для здійснення корисної роботи, її часто називають зв'язаною енергією. Інша частина теплоти (Δ G) може бути використана для здійснення роботи, тому енергію Гіббса часто називають також вільною енергією.
, тобто деяка кількість теплоти витрачається на збільшенні ентропії (T Δ S), ця частина енергії втрачена для здійснення корисної роботи, її часто називають зв'язаною енергією. Інша частина теплоти (Δ G) може бути використана для здійснення роботи, тому енергію Гіббса часто називають також вільною енергією.
Характер зміни енергії Гіббса дозволяє судити про принципову можливість здійснення процесу. При Δ G < 0 процес може перебігати, при Δ G > 0 процес перебігати не може (іншими словами, якщо енергія Гіббса в початковому стані системи більше, ніж в кінцевому, то процес принципово може перебігати, якщо навпаки - то не може). Якщо Δ G = 0, то система перебуває в стані хімічної рівноваги.Існує корисне співвідношення, що зв'язує зміну вільної енергії Гіббса 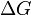 у ході хімічної реакції з її константою рівноваги
у ході хімічної реакції з її константою рівноваги  :
:
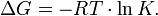
Взагалі кажучи, будь-яка реакція може бути розглянута як зворотна (навіть якщо на практиці вона такою не є). При цьому константа рівноваги визначається як
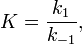
де  - константа швидкості прямої реакції,
- константа швидкості прямої реакції, 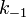 - константа швидкості зворотної реакції.
- константа швидкості зворотної реакції.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 689; Нарушение авторских прав?; Мы поможем в написании вашей работы!