
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гази , рідини, тверді тіла. Гомогенні та гетерогенні системи. Поверхні поділу фаз. Поверхневі явища. Поверхневий натяг
|
|
|
|
Білет 5
Подвійний електричний шар
Подві́йний електри́чний шар (ПЕШ)— тонкий шар на межі двох фаз із просторово розділених електричних зарядів протилежного знаку. У випадку ліозолей ПЕШ складається з йонів одного знаку, які міцно зв'язані з дисперсною фазою (потенціалвизначальні йони), і еквівалентної кількості протилежно заряджених йонів, які знаходяться у рідкому дисперсійному середовищі біля міжфазної поверхні (протийони). Заряд на поверхні твердої фази розглядається як поверхневий заряд. Структура шару протийонів згідно теорії Гуї-Чепмена складається з двох шарів — щільного і дифузного. Наявність останнього пояснюється тепловим рухом молекул.
Утворення ПЕШ суттєво впливає на стійкість дисперсних систем, змочуваність тіл, адсорбцію, коефіцієнт тертя на межі двох фаз та інші властивості міжфазної границі і відповідно, процеси, які пов'язані з міжфазними ефектами: флотацію, брикетування зі зв'язуючим, аґломерацію, зневоднення, седиментацію, фільтрацію і т. д.
Газ — один із агрегатних станів речовини, для якого характерні великі відстані між частинками порівняно з твердим і рідинним станами, мала міжмолекулярна взаємодія між ними, невпорядкованість, а середня кінетична енергія руху молекул набагато більша за енергію взаємодії між ними. Характеристичною властивістю газу є те, що він здатний вільно поширюватися в усьому доступному для нього просторі, рівномірно заповнюючи його. На відміну від рідини та твердого тіла газ не утворює поверхні. Характерним прикладом газу є повітря. Газами називають також хімічні речовини, які перебувають в газоподібному стані за нормальних умовах. В цьому сенсі повітря складається з кількох газів — азоту, кисню, діоксиду вуглецю, аргону та інших. Гази завжди змішуються. Газ — ізотропна речовина, тобто його властивості не залежать від напрямку. Основною характеристикою газу є його густина, тобто маса газу в одиниці об'єму. Іншою характеристикою є тиск. Газ має високу стисливість — при збільшенні тиску зростає його густина. Перетворення рідини в газ називається випаровуванням, а безпосерденє перетворення твердого тіла в газ — сублімацією. Для газу характерні високий коефіцієнт самодифузії. Гази мають невисоку теплопровідність, Електропровідність газів дуже низька. Вільний газ (рос. газ свободный; англ. free gas; нім. freies Gas n) — газові компоне нти, в яких частинки газу (молекули, атоми) рухаються вільно, рівномірно заповнюючи за відсутності зовнішніх сил увесь наданий їм об'єм у пористих та тріщинуватих гірських породах, у повітряній атмосфері Землі. Ідеальний газ (рос. идеальный газ; англ. ideal gas, нім. ideales Gas n) — це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями до ідеального газу є реальні розріджені гази. Насичений газ (рос. газ насыщенный; англ. saturated gas; нім. gesättigtes Gas n) — вологий газ, в якого парціальний тиск пари дорівнює тиску насичення при заданій температурі. Протилежне — ненасичений газ. Ненасичений газ (рос. газ ненасыщенный; англ. unsaturated gas; нім. ungesättigtes Gas) — вологий газ, в якого парціальний тиск пари є меншим тиску насичення при заданій температурі.
Рідина — конденсований агрегатний стан речовини, проміжний між твердим та газоподібним. Фізичне тіло, якому притаманні:а) плинність, на відміну від твердого тіла;б) достатньо мала зміна об’єму (при зміні тиску й температури), на відміну від газу.
Збереження об’єму, густина, показник заломлення, теплота плавлення, в’язкість — властивості, які зближують рідини з твердими тілами, а незбереження форми – з газами. Для рідин характерний ближній порядок розташування молекул (відносна впорядкованість у розташуванні молекул найближчого оточення довільної молекули, подібна до порядку в кристалічних тілах, але на відстані кількох атомних діаметрів ця впорядкованість порушується). Взаємодія між молекулами рідини здійснюється Ван дер Ваальсовими і водневими зв’язками. Рідини, крім розсолів та зріджених металів, погані провідники електричного струму. Якщо рідина перебуває в стані спокою в однорідному гравітаційному полі, тиск на будь яку точку визначається барометричною формулою:
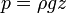
де:
-
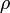 = густина рідини,
= густина рідини, -
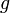 = прискорення вільного падіння,
= прискорення вільного падіння, -
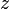 = глибина точки (відстань між точкою та поверхнею рідини).
= глибина точки (відстань між точкою та поверхнею рідини).
Рідина при температурі кипіння перетворюється на газ, а при температурі замерзання — на тверду речовину. Але навіть при температурі, нижчій за температуру кипіння, рідина випаровується. Всі рідини можна розділити на чисті рідини, що складаються з молекул однієї речовини, й суміші, які складаються з молекул різного сорту. Здебільшого рідини — ізотропні речовини. Виняток складають рідкі кристали, які можна віднести до рідин з огляду на властивість перетікати й займати об'єм посудини, але в яких зберігаються властиві кристалічним тілам анізотропні властивості. Молекули рідин здебільшого коливаються навколо тимчасового положення рівноваги, яке утворюється завдяки взаємодії з іншими молекулами. Для рідин потенціальна енергія взаємодії молекули з сусідами більша, ніж кінетична енергія теплового руху. Однак рідини характеризуються також високим коефіцієнтом самодифузії
Тверде́ ті́ло — агрегатний стан речовини, що характеризується стабільністю форми на відміну від інших агрегатних станів рідини та газу. Атоми твердих тіл більшість часу проводять в околі певних рівноважних положень, здійснюючи тільки незначні теплові коливання. За типом упорядкування атомів розрізняють кристалічні і аморфні тверді тіла. За типом зв’язку між атомами розрізняють тверді тіла з ковалентним, іонним, металічним зв’язками тощо. Електричні, магнітні і деякі інші властивості твердих тіл визначаються переважно характером руху валентних електронів його атомів. У зв’язку з цим тверді тіла поділяються за електричними властивостями на діелектрики, напівпровідники, метали, сегнетоелектрики; за магнітними — на діамагнетики, парамагнетики, феромагнетики, антиферомагнетики.При підвищенні температури тверді тіла переходять у рідкий або газоподібний стан Перехід твердого тіла в рідину називається плавленням, а перехід у газоподібний стан, минаючи рідкий,— сублімацією. Перехід до твердого тіла (при зниженні температури) — кристалізація, до аморфної фази — склування.
Розрізняють гомогенні і гетерогенні системи. Гомогенної називається система, що складається з однієї фази, гетерогенної-система, що складається з декількох фаз. Фазою називається частина системи, відокремлена від інших її частин поверхнею розділу, при переході через яку властивості змінюються стрибком.
Прикладом гомогенної системи може служити будь-яка газова суміш (всі гази при не дуже високих тисках необмежено розчиняються один в друге), хоча б суміш азоту з киснем. Іншим прикладом гомогенної системи може служити розчин декількох речовин в одному розчиннику, наприклад розчин хлориду натрію, сульфату магнію, азоту і кисню у воді. У кожному з цих двох випадків система складається тільки з однієї фази, з газової фази в першій прикладі і з водного розчину в другому. Як приклади гетерогенних систем можна навести наступні системи: вода з льодом, насичений розчин з осадом, вугілля і сірка в атмосфері повітря. В останньому випадку система складається з трьох фаз: двох твердих і однієї газової. Якщо реакція протікає в гомогенної системі, то вона йде на всьому обсязі цієї системи. Якщо реакція протікає між речовинами, що утворюють гетерогенну систему, то вона може йти тільки на поверхні розділу фаз, утворюють систему. Швидкість гомогенної реакції та швидкість гетерогенної реакції визначаються по-різному. Швидкістю гомогенної реакції називається кількість речовини, вступає в реакцію або утворюється при реакції за одиницю часу в одиниці об'єму системи. Швидкістю гетерогенної реакції називається кількість речовини, що вступає в реакцію або утворюється при реакції за одиницю часу на одиниці площі поверхні фази.
До поверхневих належить ряд явищ, зв'язаних з особливими властивостями поверхневого
шару — перехідної області між двома стичними фазами.
Міжфазні поверхні існують тільки в гетерогенних системах, де є рідка або тверда фаза. До
таких систем, зокрема, належать рослинний і тваринний світ, ґрунт тощо. Виникнення поверхневих явищ зумовлено силами міжмолекулярної взаємодії, котрі особливо яскраво виявляються на міжфазних межах поділу. На рис. 19.1. схематично зображена геометрична поверхня поділу рідина—газ (лінія АВ).
Збільшення площі поверхні поділу фаз зв'язане з переходом молекул із глибини фази на
поверхню, для чого необхідно виконати роботу проти сил внутрішнього тиску. Ця робота dW в оборотних ізотермічних умовах пропорційна площі поверхні dS, яка утворюється:
dW = dS де — коефіцієнт пропорційності, який називається поверхневим натягом. Фізичний зміст полягає в тому, що він чисельно дорівнює роботі утворення одиниці поверхні. Робота, витрачена на збільшення площі поверхні, перетворюється у потенційну енергію молекулповерхневого шару. Звідси випливає, що молекули поверхневого шару набувають надлишкового запасу енергії порівняно з молекулами усередині фази, який називається поверхневою енергією. В залежності від умов (р = соnst або V = соnst) збільшується енергія Гіббса GS або енергія Гельмгольца FS. Тоді фізичний зміст поверхневого натягу може бути розшифрований як питома надлишкова поверхнева енергія, або це сила, яка намагається скоротити вільну поверхню тіла до найменших можливих меж. Розмірність поверхневого натягу [] = Дж/м2 = Н/м. Величина є важливою молекулярною константою (при Т = соnst).
Разом з такими параметрами, як дипольний момент , поляризовність та діелектрична
проникність є, вона характеризує інтенсивність поля молекулярних сил, яка позначається
загальним терміном полярність рідини.
Поверхневий натяг залежить від температури, природы фаз, які контактують, концентрації
розчинених речовин. 1. Підвищення температури веде до зниження поверхневого натягу на межі рідина-газ. 2. Поверхневий натяг в значній мірі визначається природою рідини, особливо її полярністю. Саме полярність визначаєсилу взаимодії між молекулами рідини. Чим більш полярна рідина, тим вище її поверхневий натяг.
ПОВЕРХНЕВИЙ НАТЯГ (МІЖФАЗНИЙ НАТЯГ) — найважливіша термодинамічна характеристика поверхні поділу фаз (тіл), яка визначається міжмолекулярними взаємодіями та структурою поверхневого шару. 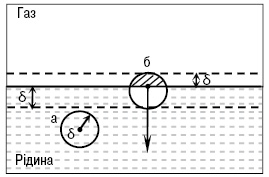
Модель геометричної поверхні поділу рідина газ (δ ~10-9): а – молекула в об’ємі рідини; б – молекула поблизу поверхні
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1831; Нарушение авторских прав?; Мы поможем в написании вашей работы!