
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Залежність швидкості реакції від концентрації реагуючих речовин - закон діючих мас
|
|
|
|
Необхідною умовою перебігу хімічної реакції є зіткнення їх молекул. Ймовірність зіткнення взаємодіючих молекул для гомогенної реакції пропорційна концентраціям реагуючих речовин.
Таким чином, закон дії мас: швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин в ступенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції.
Для загальної реакції
a A + b B = c C + d D
швидкість дорівнює:
v = k Ca(A)Cb(B) = k [A]a[B]b.
Для реакції
2NO + Cl2 = 2NOCl
швидкість v = k C2(NO)C(I2).
Константа швидкості k – це швидкість реакції за умови, що концентрації реагуючих речовин дорівнюють 1 моль/л.
Рівняння, що пов’язує швидкість реакції з концентраціями реагентів, називають рівнянням швидкості, або кінетичним рівнянням реакції.
Перебіг більшості хімічних реакцій такий, що утворення продуктів відбувається через ряд проміжних елементарних стадій. Кожна з цих реакцій описується своїм кінетичним рівнянням. Тоді вступає в силу один з принципів кінетики – принцип лімітуючої стадії: швидкість складної реакційї визначається швидкістю найповільнішої (лімітуючої) елементарної стадії.
Сума показників ступенів в рівнянні швидкості хімічної реакції (кінетичного рівняння) є важливою характеристикою механізму процесу і називається порядком хімічної реакції. Окремі показники ступенів концентрацій реагентів визначають порядок реакції щодо даної речовини.
Якщо порядок нульовий (швидкість не залежить від концентрації реагуючих речовин), то v = k чи  .
.
Це, наприклад, реакція розкладу кальцій карбонату: CaCO3®CaO+CO2.
Швидкість реакції першого порядку описується кінетичним рівнянням
v = k C.
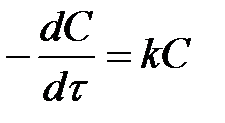 .
.
після інтегрування ми отримаємо
kt = ln(C0/C).
Приклад:
N2O5 = 2NO2 + 1/2O2.
Для реакцій другого порядку кінетичне рівняння має вигляд
v = k C2; v = k CACB
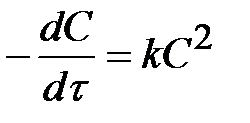 .
.
Інтегрування цього рівняння дає таку залежність концентрації речовини від часу перебігу реакції
kt = 1/C - 1/C0
Приклад:
H2 + I2 = 2HI
розклад нітроген (IV) оксиду: 2NO2 = 2NO + O2.
Реакції третього порядку описуються кінетичними рівняннями
v = kC3 = kC12C2 = kC1C2C3.
Залежність концентрації від часу виражається рівнянням:
1/C  – 1/C
– 1/C  = 2kt
= 2kt
Приклад:
2NO + O2 = 2NO2;
2NO + Br2 = 2NOBr.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1374; Нарушение авторских прав?; Мы поможем в написании вашей работы!