
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Динаміка процесів у розчинах. Розчини неелектролітів та електролітів. Закони Рауля. Осмос. Енергетика розчинення. Способи виразу концентрації розчину
|
|
|
|
ЕКЗАМЕНАЦІЙНИЙ БІЛЕТ № 21
Розчини – це гомогенні (однорідні) системи, що складаються з двох і більше компонентів і продуктів їх взаємодії. Розчином називають дво- або багатокомпонентну гомогенну систему, склад якої може безперервно змінюватися у межах, визначених розчинністю. За агрегатним станом розчини бувають рідкі, тверді і газоподібні.
Газоподібні розчини – це суміші газів. Тверді розчини отримують частіше всього при кристалізації рідких розчинів. Гомогенні тверді розчини можуть утворювати солі, метали або оксиди. Відомі тверді розчини двох типів: заміщення і вкорінення. Рідкі розчини утворюються при розчиненні газоподібних, рідких або твердих речовин у дисперсійному середовищі (розчиннику). У рідких розчинах розчинником, як правило, є рідини, зокрема вода. За розчинник вважають той компонент розчину, агрегатний стан якого не змінюється, тобто залишається рідким. Розчини речовин з молярною масою менше 5000 г/моль називають розчинами низькомолекулярних сполук (НМС), а розчини речовин з молярною масою понад 5000 г/моль – розчинами високомолекулярних сполук (ВМС). За наявністю або відсутністю електролітичної дисоціації розчини НМС діляться на розчини електролітів і неелектролітів.
Розчини електролітів являють собою особливі рідини, які частково або повністю перебувають у вигляді заряджених частинок (іонів). Сам процес розщеплення молекул на негативно (аніони) і позитивно заряджені (катіони) частинки називають електролітичної дисоціацією. Дисоціація в розчинах можлива тільки завдяки здатності іонів взаємодіяти з молекулами полярної рідини, яка виступає в якості розчинника.Розчини електролітів діляться на водні і неводні. Водні вивчені досить добре і отримали дуже широке поширення.Розчини електролітів залежно від ступеня дисоціації можна розділити на сильні, середні і слабкі. До сильних електролітів зазвичай відносять солі, ряд деяких кислот – HCl, HBr, HI, HNO3, H2SO4, HClO4, гідроксиди барію, стронцію, кальцію і лужних металів. Інші підстави і кислоти – електроліти середньої або слабкої сили.
Концентрація речовини – це величина, що вимірюється кількістю розчиненої речовини, що міститься у певній масі чи об’ємі розчину або розчинника.
1. Масова доля ω - кількість г речовини, що міститься у 100 г розчину чи сухої речовини, виражається у долях одиниці або відсотках %: ω (Х) = m (Х)/m (розчину); ω (Х) = m (Х)*100 %/m (розчину).
2. Молярна концентрація c (Х ) – кількість молей речовини, що міститься у 1 л (або дм3) розчину, виражається у моль/л, моль/дм3: c (Х) = n (Х)/ V (розчину) = m (Х)/ M (Х)V (розчину).
Еквівалентом називають реальну або умовну частку речовини Х, яка може приєднувати, вивільнювати або бути будь-яким іншим чином еквівалентна одному іону гідрогену в даній кислотно-основній реакції або одному електрону в окислювально-відновній реакції.
Фактор еквівалентності f екв.(Х) – це число, яке позначає, яка доля реальної частки речовини Х еквівалентна одному іону гідрогену в даній кислотно-основній реакції або одному електрону в окислювально-відновній реакції: f екв.(Х) = 1/z, де z – основність кислоти або кислотність основи даної кислотно-основної реакції, а також електронів, що приймають участь у даній окислювально-відновній реакції. z- величина безрозмірна.
Молярна маса еквівалента речовини Х (маса одного моля еквівалента речовини) – величина, яка вимірюється добутком фактора еквівалентності на молярну масу речовини Х: M (1/z X) = 1/z M (X), де M (1/z X) – молярна маса еквівалента. (г/моль)
3. Молярна концентрація еквівалентів (нормальна концентрація) c(1/zХ). – кількість молей еквівалентів речовини, що міститься у 1 л (або дм3) розчину, виражається у моль/л, моль/дм3: c (1/z X) = n (1/z X)/ V(розчину), де n (1/z X) – кількість речовини еквівалентів, моль.
Молярна концентрація і молярна концентрація еквівалентів зв’язані співвідношенням: c (1/z (X)) = zc (X).
4. Титр розчину T (Х) – концентрація розчину, яка показує кількість розчиненої речовини у г, що міститься у 1 мл розчину: T (Х) = m (X)/V (розчину).





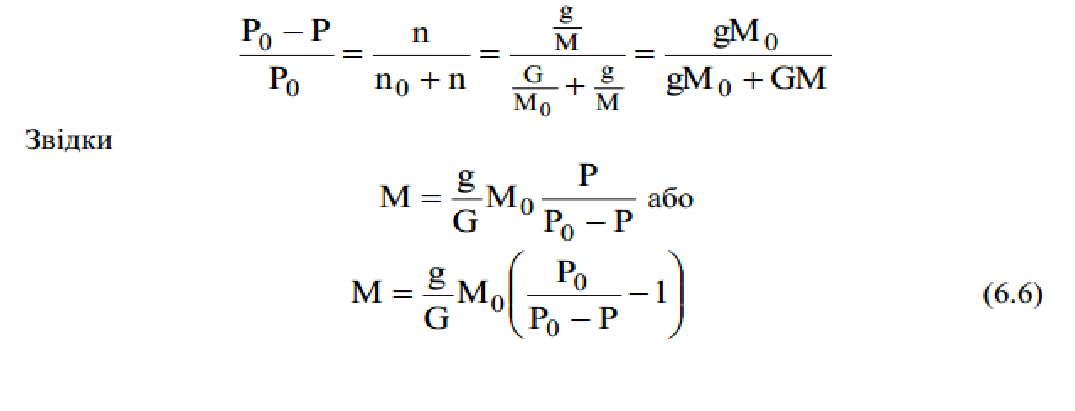




|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1058; Нарушение авторских прав?; Мы поможем в написании вашей работы!