
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
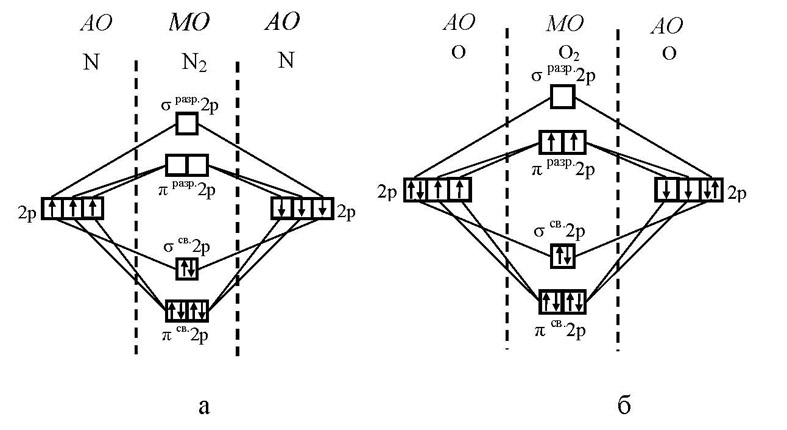
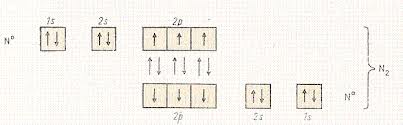
ММО: N2 МВЗ: N2
|
|
|
|
Нітроген та азот. Будова молекули азоту за МВЗ та ММО. Гідрогеновмісні сполуки нітрогену, їх молекулярна будова, властивості та порівняльна характеристика. Особливості поведінки сполук нітрогену з гідрогеном у водних розчинах.
Білет № 5
Теми рефератів
1. Соціологічна інтерпретація понять "індивід", "індивідуальність", "особистість".
2. Специфіка етапів соціалізації індивіда.
3. Структура соціального статусу особистості.
4. Характеристики визначальних чинників соціальної діяльності.
& Використана і рекомендована література
1. Кон И.С. Социология личности.— М., 1967.
2. Соціологія. Посібник для студентів вищих навчальних закладів / За ред. проф. В.Г.Городяненка.— К., 1999.
3. Современная западная социология. Словарь.— М., 1996.
5. Социология. Наука об обществе. Учебное пособие для студентов высших учебных заведений / Под ред. В.П.Андрущенко.— Харків, 1996
5. Щекин Г.В. Система социологического знания. Уч. пособие._К. 1995
6. Якуба О.О. Соціологія.— Харків, 1996.
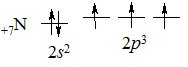 Нітроген –перший елемент VА групи Періодичної системи. На зовнішньому електронному рівні містить 5 електронів – 2 s 22 p 3:
Нітроген –перший елемент VА групи Періодичної системи. На зовнішньому електронному рівні містить 5 електронів – 2 s 22 p 3:
Завдяки наявності трьох неспарених р -електронів, атом Нітрогену може утворювати три ковалентні хімічні зв’язки за обмінним механізмом і ще один – за донорно-акцепторним, за рахунок неподіленої пари 2 s -електронів. Тому максимальна валентність Нітрогену дорівнює 4. Ступені окиснення Нітрогену змінюються від –3 (приймає 3 електрони) до +5 (віддає 5 електронів).
Проста речовина–азот –двоатомний газ N2, атоми у молекулі якого сполучені трьома ковалентними неполярними зв’язками: N≡N. Завдяки такому зв’язку молекула азоту міцна і хімічно інертна.
Поширення у природі. Основна маса азоту зосереджена в атмосферному повітрі (78% за об’ємом). У великій кількості зв’язаний азот міститься в чилійській селітрі NaNO3. Зв’язаний азот міститься в усіх живих організмах у складі білків та нуклеїнових кислот.
Одержання. У лабораторії азот одержують нагріванням амоній нітриту NH4NO2: NH4NO2=N2+2H2O, або дією газоподібного амоніаку NH3 на розпечений CuO: 3CuO+2NH3=N2+Cu+3H2O.
У промисловості азот одержують з повітря шляхом глибокого охолодження і наступною фракційною перегонкою.
Фізичні властивості. За н. у. азот – безбарвний газ без запаху і смаку, легший за повітря. При –195,8 0С зріджується. Малорозчинний у воді (при 20 0С у 100 г води розчиняється 15,4 мл азоту).
Хімічні властивості. 1)6Li + N2 = 2Li3N; 3Mg + N2 = Mg3N2;2)N2 + 3H2 = 2NH3; 3)NO:N2 + O2 ↔ 2NO,який на повітрі окиснюється до NO2: 2NO + O2 ↔ NO2.
Застосування. Основну масу азоту використовують у промисловості для синтезу амоніаку; заповнюють електролампи; для створення інертної атмосфери при зварювальних роботах. Рідкий-використовують у холодильних установках для одержання низьких температур.
Гідрогеновмісні сполуки Нітрогену: NH3 – аміак; N2H4 (або H2N–NH2) – гідразин; NH2OH – гідроксиламін; HN3 – азидна кислота.
Аміак, NH3 – безбарвний газ з різким специфічним запахом. При підвищеному тиску аміак легко зріджується навіть за кімнатної температури. Добре розчинний у воді. Розчин аміаку у воді називають аміачної водою або нашатирним спиртом. У медицині застосовують нашатирний спирт, що містить 10% NH3.
В лабораторії: NH4Cl + NaOH = NaCl + NH3 + H2O.
В промисловості: N2 + 3H2 2NH3,каталізатором є пористе залізо з активними добавками – Al2O3 i K2O.
В невеликих кількостях аміак утворюється при коксуванні вугілля. До розробки методу синтезу аміаку з водню та азоту його отримували так званим ціанамідним методом: з карбіду кальцію отримували ціанамід кальцію, який потім обробляли водяною парою: CaC2 + N2 = CaCN2 + C; CaCN2 + 3H2O = CaCO3 + 2NH3.
Рідкий аміак – іонізуючий розчинник. У ньому розчиняються різні солі, кислоти, деякі прості речовини (сірка, йод, фосфор, лужні та лужноземельні метали).
Взаємодія аміаку з водою полягає в утворенні водневих зв’язків між атомами Гідрогену води й атомами Нітрогену аміаку. Цей зв’язок наближається до донорно-акцепторного. Під час розведення NH3H2O дисоціація на іони відбувається лише частково:
NH3 + H2O NH3H2O NH4++ OH–.
Водний розчин аміаку – це слабка основа, за традицією його зображають формулою NH4OН і називають гідроксидом амонію.
NH3H2O + HCl = NH4Сl + H2O;
2NH3H2O + CO2 = (NH4)2CO3 + H2O.
З кислотами також взаємодіє сухий аміак, утворюючи солі амонію:
NH3 + HCl = NH4Сl;
NH3 + HNO3 = NH4NO3.
Більшість солей амонію добре розчинні у воді.
Амонійні солі летких кислот під час нагрівання розкладаються повністю:
(NH4)2CO3 = 2NH3 + CO2 + H2O;
NH4Cl = NH3 + HCl.
Солі, утворені нелеткими кислотами, розкладаються тільки частково:
(NH4)2SO4 = NH3 + NH4HSO4.
Окремі солі амонію і нелетких кислот розкладаються під час нагрівання за такими реакціями:
(NH4)3PO4 = 3NH3 + H3PO4;
2MgNH4PO4 = Mg2P2O7 + 2NH3 + H2O.
(пірофосфат магнію)
Нітрат та нітрит амонію розкладаються відповідно з утворенням оксиду Нітрогену (І) і води та азоту і води:
NH4NO3 = N2O + 2H2O;
NH4NO2 = N2 + 2H2O.
NH4+ + HOH NH4OH + H+.
4NH3 + 3O2 = 2N2 + 6H2O (без каталізатора);
4NH3 + 5O2 = 4NО + 6H2O (каталізатор – Pt-Rh, T = 750 oC);
2Al + 2NH3 = 2AlN + 3H2.
2Na + 2NH3 = 2NaNH2 + H2; амід натрію
2Na + NH3 = Na2NH + H2. імід натрію
NaNH2 + H2O = NaOH + NH3.
K2Cr2O7 + (NH4)2SO4 = K2SO4 + Cr2O3 + N2 + 4H2O;
NaNO2 + NH4Cl = N2 + NaCl + 2H2O;
2NH3 + NaOCl = NaCl + N2H4 + H2O.
Застосування аміаку: – у холодильних установках; – водні розчини аміаку – у медицині та побуті;– для виготовлення нітратної кислоти та азотних добрив (сульфат і нітрат амонію, карбамід). Нітрат амонію є цінним мінеральним добривом, в ньому дуже високий відсотковий вміст Нітрогену. що засвоюється рослинами; – хлорид амонію, NH4Cl, застосовується для паяння (сприяє видаленню з поверхні металу оксидних плівок), при фарбуванні, у гальванічних елементах.
Гідразин, N2H4 – безбарвна рідина з температурою плавлення 2 оС і температурою кипіння 113,5 оС. З водою і спиртом гідразин змішується у будь-яких співвідношеннях. Водні розчини гідразину мають лужну реакцію. Оскільки в молекулі гідразину атоми нітрогену мають неподілені пари електронів, гідразин здатний до реакцій приєднання. Подібно до аміаку, гідразин має підвищену електроно-донорну здатність, основні властивості гідразину виражені сильніше, ніж в аміаку. Гідразин може приєднувати не лише протон, але й поляризований атом Гідрогену:
N2H4 + 2H2O N2H6(OH)2 N2H62++ 2OH–.
N2H6(OH)2 – слабка двохкислотна основа. З кислотами гідразин утворює два ряди солей – солі гідразонію [N2H6]Cl2 i [N2H5]Cl.
5N2H4 + 4KMnO4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O.
Гідразин і всі його сполуки дуже отруйні.
Гідроксиламін, NH2OH – біла кристалічна речовина з температурою плавлення 33 оС, його пара шкідливо впливає на організм людини. Гідроксиламін можна добути при електрохімічному відновленні нітратної кислоти атомарним воднем:
HNO3 + 6H = NH2OH + 2H2O.
NH2OH + H2O NH3OH++ OH–(Кдис = 210–8)
4FeSO4 + 2NH2OH + 3H2SO4 = 2Fe2(SO4)3 + (NH4)2SO4 + 2H2O (окисник);
2NH2OH + J2 + 2KOH = N2 + 2KJ + 4H2O (відновник).
Гідроксиламін та його солі застосовують у органічному синтезі.
N2H4 + HNO2 = HN3 + 2H2O
Азидна кислота, HN3 – безбарвна рідина з різким запахом і температурою плавлення 36оС. Азидну кислоту також добувають з її солей – азидів, діючи на них іншими кислотами. HN3 H++ N3–.
Азиди, як і азидна кислота, мають низьку термічну стійкість. Азиди малоактивних металів (меркурію, аргентуму, плюмбуму) розкладаються з вибухом під час удару. Азидом плюмбуму Pb(N3)2 наповнюють капсули-детонатори.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1730; Нарушение авторских прав?; Мы поможем в написании вашей работы!