
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рівняння Шредінгера
|
|
|
|
Стаціонарне рівняння Шредінгера описує поведінку електрона в атомі (тобто електрона що рухається в полі ядра) Хвильова функція яка є розвязком рівняння Шредінгера не залежить від часу і характеризує стаціонарні стани системи.
Рівняння Щредінгера для найпростішої атомної системи- атома водню:
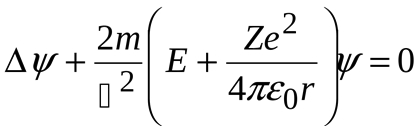
Хвильова функція містить в собі три цілочисельні параметри які називають квантовими числами
Квантові числа - це енергетичні параметри, що визначають стан електрона і тип атомної орбіталі, на якій він знаходиться. Квантові числа необхідні для опису стану кожного електрона в атомі. Всього 4-ри квантових числа. Це: головне квантове число - n, орбітальне квантове число - l, магнітне квантове число - m l і спінове квантове число - m s.
Головне квантове число - n - визначає енергетичний рівень електрона, віддаленість енергетичного рівня від ядра і розмір електронної хмари. Головне квантове число приймає будь-які цілочисельні значення, починаючи з n = 1 (n = 1,2,3,...) і відповідає номеру періоду.
Орбітальне квантове число - l - визначає геометричну форму атомної орбіталі. Орбітальне квантове число приймає будь-які цілочисельні значення, починаючи з l = 0 (l = 0,1,2,3,... n -1). Незалежно від номера енергетичного рівня, кожному значенню орбітального квантового числа відповідає орбіталь особливої форми.
Магнітне квантове число - m l - визначає орієнтацію орбіталі в просторі щодо зовнішнього магнітного або електричного поля. Магнітне квантове число приймає будь-які цілочисельні значення від-l до + l, включаючи 0. Це означає, що для кожної форми орбіталі існує 2l +1 енергетично рівноцінних орієнтацій у просторі - орбіталей.
Спіновое квантове число - m s - визначає магнітний момент, що виникає при обертанні електрона навколо своєї осі. Спіновое квантове число може приймати лише два можливих значення +1 / 2 і -1 / 2. Вони відповідають двом можливим і протилежним один одному напрямками власного магнітного моменту електрона - спинах.
Енергетичний рівень — дозволене значення енергії в квантовій механіці. Сукупність енергетичних рівнів називають енергетичним спектром. Математично енергетичний рівень є власним значенням оператора енергії, гамільтоніана. Кожен енергетичний рівень відповідає одному або кільком стаціонарним станам квантової системи. У випадку, коли таких станів кілька енергетичний рівень називають виродженим.
Енергетичний спектр може бути дискретним або неперервним. Дискретний спектр виникає у разі локалізованих станів. Значення енергії у проміжках між дискретними рівнями, не відповідають жодному стаціонарному стану квантової системи, отже є забороненими.
При́нцип Па́улі — квантово-механічний принцип, згідно з яким у багаточастинковій системі невзаємодіючих ферміонів, ніякі дві частки не можуть описуватися хвильовими функціями з однаковим набором усіх квантових чисел.
Принцип Паулі формально означає неявну взаємодію в багаточастинковій системі, навіть коли явної взаємодії нема, оскільки коли відомий стан однієї частинки, то водночас достеменно відомо, що жодна інша частинка не перебуває у цьому стані. Особливо яскраво принцип виявляється, коли система невелика, така як s-орбіталь атома, на котрій може перебувати не більше двох електронів одночасно.
Розглянемо два електрони, просторові координати яких збігаються, тоді якщо спінові координати теж збігаються (спіни співнапрямлені), то електрони не можуть перебувати в одній точці, але якщо спіни напрямлені у протилежні сторони, то електрони можуть знаходитися в одній точці простору.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2986; Нарушение авторских прав?; Мы поможем в написании вашей работы!