
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язування типових задач
|
|
|
|
Індивідуальне завдання № 2
Задача 1. Початкові концентрації вихідних речовин у реакції 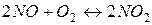 відповідно рівні:
відповідно рівні: 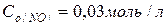 і
і 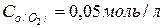 . Розрахуйте концентрації кисню і нітроген (IV) оксиду, якщо концентрація нітроген (ІІ) оксиду стала рівною 0,01 моль/л.
. Розрахуйте концентрації кисню і нітроген (IV) оксиду, якщо концентрація нітроген (ІІ) оксиду стала рівною 0,01 моль/л.
Розв’язок. За умовою задачі витратилося 0,03 – 0,01 = 0,02 моль нітроген (ІІ) оксиду. Згідно з рівнянням реакції при цьому прореагувало 0,01 моль кисню і утворилося 0,02 моль нітроген (IV)оксиду. Тому концентрації речовин рівні:
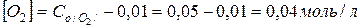
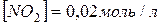
Задача 2. Зворотна реакція протікає за рівнянням 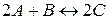 . Чому рівна константа рівноваги цієї реакції, якщо рівноважні концентрації речовин рівні
. Чому рівна константа рівноваги цієї реакції, якщо рівноважні концентрації речовин рівні 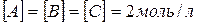 ?
?
Розв’язок. Згідно із законом діючих мас запишемо вираз для константи рівноваги
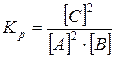
Підставивши значення концентрацій, одержимо
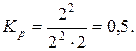
Задача 3. В 450 г води розчинили 50 г мідного купоросу. Розрахуйте масову частку /%/ солі в розчині.
Розв’язок. Молярні маси кристалогідрату і купрум сульфату рівні:
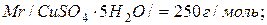

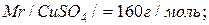
Знайдемо масу купрум сульфату в 50 г мідного купоросу:
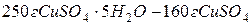

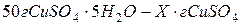
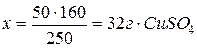

Маса розчину рівна 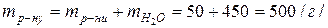
Відповідно, масову частку солі розраховуємо за формулою:
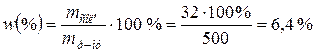
Задача 4. Скільки грамів 10%-ного розчину Н2SO4 треба для нейтралізації 100мл 13,7%-ного розчину Na2CO3 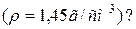
Розв’язок. 100 мл розчину масою 114, 5 г містить 114,5.0,137=15,68 г Na2CO3.
З рівняння реакції 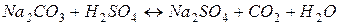
знаходимо необхідну кількість сірчаної (сульфатної) кислоти
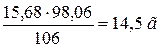
10 %-ного розчину H2SO4 необхідно 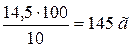 .
.
Задача 5. Розрахувати молярність і нормальність 49 %-ного розчину H3PO4 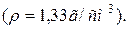
Розв’язок. 1 л розчину має масу 1330 г і містить 1330.0,49 = 651,7 г фосфатної кислоти, що складає 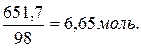 Розчин є 6,65 М або 6,65.3 = 19,95 н.
Розчин є 6,65 М або 6,65.3 = 19,95 н.
Задача 6. Скільки грамів 90 %-ної сірчаної кислоти треба прилити до 500 г 10 %-ної кислоти, щоб одержати 70 %-ний розчин?
Розв’язок. Використовуємо правило змішування (хреста)
90 
 60 70-10 = 60
60 70-10 = 60
 70
70
10 20 90-70 = 20
Таким чином, для одержання 80 г 70 %-ного розчину треба змішати 60 г 90 %-ного розчину і 20 г 10 %-ного розчину.
Складаємо пропорцію:
 20 г 10 % – 60 г 90 %
20 г 10 % – 60 г 90 %
500 г 10 % – x г 90 %
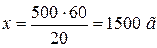
Якщо в задачах подібного типу концентрації наведені у відсотках, а розчини – в об’ємах, то останні треба перевести в масові одиниці, помножити об’єми розчинів на їх густини. Для знаходження значень густин розчинів скористайтеся довідником.
Задача 7. Розрахуйте температуру кристалізації і кипіння розчину, що містить 9 г глюкози і 100 г води 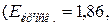
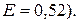
Розв’язок. За другим законом Рауля зниження температури кристалізації /замерзання/, підвищення температури кипіння розведених розчинів прямо пропорційне їх моляльній концентрації:
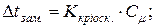
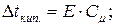
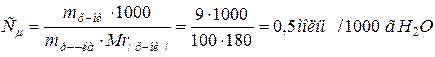
Тоді 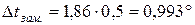
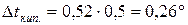
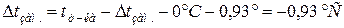
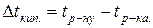
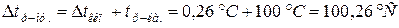
Задача 8. На скільки градусів температура замерзання водного розчину кальцій хлориду є нижча, ніж розчину цукру, якщо моляльності цих розчинів однакові і рівні 1моль /1000 г розчинника, а ступінь дисоціації кальцій хлориду рівний 0,9?
Розв’язок. Відмінність у фізичних властивостях (температура кипіння, температура замерзання, осмотичний тиск) розчинів електролітів і неелектролітів зумовлена електролітичною дисоціацією речовин. За законом Рауля пониження температури замерзання для електролітів і неелектролітів відповідно рівне:
для неелектролітів 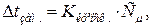
для електролітів 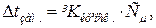
де і – ізотонічний коефіцієнт.
Ізотонічний коефіцієнт відповідно розраховуємо за формулою:
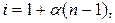
де 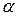 – уявний ступінь дисоціації;
– уявний ступінь дисоціації;
п – число йонів, що утворюються при дисоціації однієї молекули електроліту.
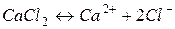
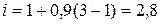
Розрахуємо пониження температури замерзання для кожного розчину:
для 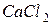
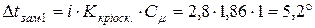
для 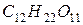
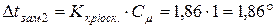
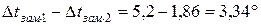
Задача 9. Добуток розчинності BaCrO4 рівний 2,3.10-10. Розрахуйте розчинність солі в моль/л.
Розв’язок: 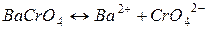
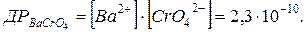
Оскільки молекула BaCrO4 дисоціює на два іони, то концентрація їх в розчині рівна концентрації кожного з йонів:
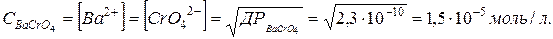
Задача 10. Чому рівна молярність йонів гідрогену в розчині, якщо pH рівний 2,43?
Розв’язок. Водневий показник pH рівний 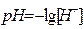 . Звідси
. Звідси 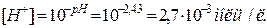
Задача 11. Чому рівний pH 0,18 М розчину NH4OH?
Розв’язок. 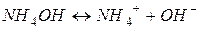
З довідника знаходимо: 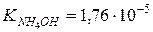
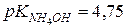
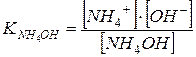 .
.
З рівняння дисоціації видно, що 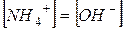
Тоді 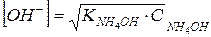
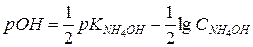
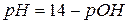
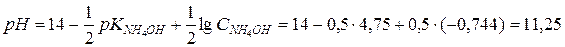 .
.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3329; Нарушение авторских прав?; Мы поможем в написании вашей работы!