
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Умови задач
|
|
|
|
1. Як зміниться швидкість реакції горіння етилену 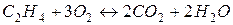 із збільшенням концентрації кисню в 3 рази?
із збільшенням концентрації кисню в 3 рази?
2. Як зміниться швидкість прямої реакції 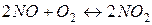 , якщо зменшити об’єм газової суміші в 4 рази?
, якщо зменшити об’єм газової суміші в 4 рази?
3. У скільки разів зменшиться швидкість реакції при зниженні температури з 70о до 40 оС, якщо температурний коефіцієнт швидкості реакції рівний 2?
4. При 150 оС деяка реакція закінчується за 16 хв. Беручи до уваги, що температурний коефіцієнт швидкості реакції рівний 2,5, розрахуйте, за скільки хвилин закінчилась би ця реакція при 200 оС.
5. Рівновага реакції 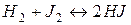 встановилася при таких концентраціях вихідних речовин і продуктів реакції:
встановилася при таких концентраціях вихідних речовин і продуктів реакції: 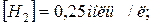
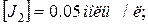
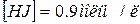 . Величина константи рівноваги рівна 1. Визначити початкові концентрації йоду і гідрогену.
. Величина константи рівноваги рівна 1. Визначити початкові концентрації йоду і гідрогену.
6. Константа рівноваги реакції 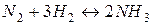 рівна 0,1 /400°С/. Рівноважні концентрації
рівна 0,1 /400°С/. Рівноважні концентрації 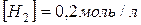 і
і 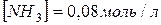 . Розрахуйте початкову і рівноважну концентрації водню.
. Розрахуйте початкову і рівноважну концентрації водню.
7. В закритій посудині протікає зворотний процес дисоціації. 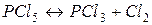 . Початкова концентрація PCl5 рівна 2,4 моль/л. Рівновага встановилась після того, як 33,3 % PCl5 піддалося дисоціації. Розрахуйте константу рівноваги.
. Початкова концентрація PCl5 рівна 2,4 моль/л. Рівновага встановилась після того, як 33,3 % PCl5 піддалося дисоціації. Розрахуйте константу рівноваги.
8. Зворотна реакція виражається рівнянням 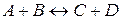 . Початкові концентрації:
. Початкові концентрації: 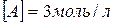 і
і 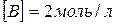 . Розрахуйте рівноважні концентрації усіх речовин, що беруть участь у цій реакції.
. Розрахуйте рівноважні концентрації усіх речовин, що беруть участь у цій реакції.
9. Реакція виражається рівнянням 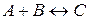 . Початкова концентрація речовини A рівна 0,3 моль/л, а речовини B – 0,5 моль/л. Константа швидкості реакції рівна 0,4. Знайдіть початкову швидкість реакції і швидкість реакції за певний проміжок часу, коли концентрація речовини зменшилась на 0,1 моля.
. Початкова концентрація речовини A рівна 0,3 моль/л, а речовини B – 0,5 моль/л. Константа швидкості реакції рівна 0,4. Знайдіть початкову швидкість реакції і швидкість реакції за певний проміжок часу, коли концентрація речовини зменшилась на 0,1 моля.
10. При нагріванні до деякої температури рівновага реакції 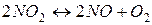 встановилася за таких умовах:
встановилася за таких умовах: 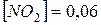 моль/л;
моль/л; 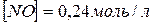 ;
; 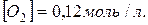 Розрахуйте константу рівноваги для цієї температури і вихідну концентрацію O 2.
Розрахуйте константу рівноваги для цієї температури і вихідну концентрацію O 2.
11. При нагріванні PCl5 дисоціює за рівнянням 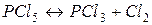 . При деякій температурі з 2 молів PCl5, що знаходиться в закритій посудині об’ємом 10 л, піддалися розкладу 1,5 моля. Розрахуйте константу рівноваги при цій температурі.
. При деякій температурі з 2 молів PCl5, що знаходиться в закритій посудині об’ємом 10 л, піддалися розкладу 1,5 моля. Розрахуйте константу рівноваги при цій температурі.
12. Константа рівноваги для реакції 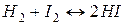 при 445° рівна 50. Скільки молів водню треба взяти на 1 моль йоду, щоб 90% йоду перетворити в HI?
при 445° рівна 50. Скільки молів водню треба взяти на 1 моль йоду, щоб 90% йоду перетворити в HI?
13. Константа рівноваги оборотної реакції 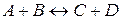 рівна 0,3. Розрахуйте рівноважні концентрації всіх речовин в моль/л.
рівна 0,3. Розрахуйте рівноважні концентрації всіх речовин в моль/л.
14. Константа рівноваги оборотної реакції 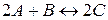 при деякій температурі рівна 2,22. Скільки молів речовини B на 1 л реакційної суміші необхідно, щоб провзаємодіяло 40 % речовини A, якщо початкова концентрація речовини A була рівна 4 моль/л?
при деякій температурі рівна 2,22. Скільки молів речовини B на 1 л реакційної суміші необхідно, щоб провзаємодіяло 40 % речовини A, якщо початкова концентрація речовини A була рівна 4 моль/л?
15. У скільки разів зросте швидкість реакції окиснення оксиду сульфуру (IV) 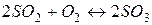 при збільшенні концентрації O 2 в 2 рази?
при збільшенні концентрації O 2 в 2 рази?
16. Реакція протікає за рівнянням 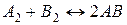 . Визначте константу рівноваги, якщо рівноважні концентрації рівні:
. Визначте константу рівноваги, якщо рівноважні концентрації рівні: 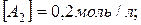
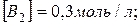
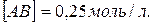
17. Константа рівноваги реакції 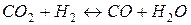 рівна при 850 °С Kр = 1. Скільки процентів CO 2 перетворилося з CO при 850 °С, якщо змішати 1 моль CO 2 з 5 молями водню?
рівна при 850 °С Kр = 1. Скільки процентів CO 2 перетворилося з CO при 850 °С, якщо змішати 1 моль CO 2 з 5 молями водню?
18. При 1000 °С константа рівноваги 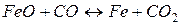 рівна 0,5. Які рівноважні концентрації CO і CO 2, якщо початкові складали:
рівна 0,5. Які рівноважні концентрації CO і CO 2, якщо початкові складали: 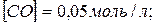
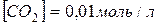 ?
?
19. У стані рівноваги системи 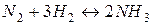 концентрації речовин рівні:
концентрації речовин рівні: 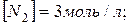
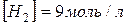 ;
; 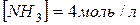 .Чому рівні вихідні концентрації водню і азоту?
.Чому рівні вихідні концентрації водню і азоту?
20. Як зміниться швидкість прямої реакції 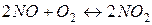 , що протікає в закритій посудині, якщо загальний тиск збільшити в 4 рази?
, що протікає в закритій посудині, якщо загальний тиск збільшити в 4 рази?
21. Реакція між речовинами A і B виражається рівнянням: 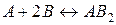 . Початкова концентрація речовини A рівна 0,3 моль/л, а речовини B – 0,5 моль/л. Константа швидкості прямої реакції рівна 0,4. Знайти початкову швидкість реакції і швидкість реакції в даний момент часу, якщо концентрація речовини A за цей час зменшилась на 0,1 моля.
. Початкова концентрація речовини A рівна 0,3 моль/л, а речовини B – 0,5 моль/л. Константа швидкості прямої реакції рівна 0,4. Знайти початкову швидкість реакції і швидкість реакції в даний момент часу, якщо концентрація речовини A за цей час зменшилась на 0,1 моля.
22. Після змішування речовин A і B в системі 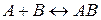 встановився стан рівноваги за таких концентрацій:
встановився стан рівноваги за таких концентрацій: 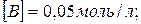
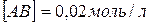 . Константа рівноваги реакції рівна 4.10-2. Знайти вихідні концентрації речовини A і B.
. Константа рівноваги реакції рівна 4.10-2. Знайти вихідні концентрації речовини A і B.
23. Константа рівноваги реакції 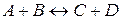 рівна Kр = 1. Початкова концентрація
рівна Kр = 1. Початкова концентрація 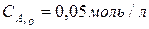 . Скільки процентів речовини A піддалося перетворенню, якщо початкова концентрація
. Скільки процентів речовини A піддалося перетворенню, якщо початкова концентрація 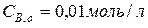 ?
?
24. При деякій температурі рівновага в системі 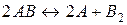 встановилася за таких концентрацій:
встановилася за таких концентрацій: 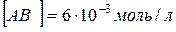 ;
; 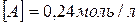 . Знайдіть константу рівноваги реакції і вихідну концентрацію речовини AB.
. Знайдіть константу рівноваги реакції і вихідну концентрацію речовини AB.
25. Константа рівноваги реакції 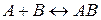 рівна Kр = 1. Скільки процентів речовини A перетвориться, якщо змішати 6 молів речовини A і 10 молів речовини B?
рівна Kр = 1. Скільки процентів речовини A перетвориться, якщо змішати 6 молів речовини A і 10 молів речовини B?
26. Розрахуйте рівноважну концентрацію водню в системі 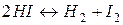 , якщо вихідна концентрація HI рівна 0,05 моль/л, а константа рівноваги Kр = 0,02.
, якщо вихідна концентрація HI рівна 0,05 моль/л, а константа рівноваги Kр = 0,02.
27. Розрахуйте константу рівноваги реакції 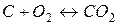 , якщо парціальний тиск CO2 в стані рівноваги складає 20 % загального тиску газової суміші.
, якщо парціальний тиск CO2 в стані рівноваги складає 20 % загального тиску газової суміші.
28. Розрахуйте рівноважні концентрації водню і йоду і константу рівноваги, якщо початкові концентрації склали 0,02 моль/л, а рівноважна концентрація HI рівна 0,03 моль/л. Процес описується рівнянням 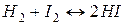 .
.
29. Вихідні концентрації речовини A і B в системі 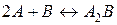 відповідно рівні 0,5 моль/л і 0,2 моль/л. Розрахуйте константу рівноваги якщо в момент встановлення рівноваги прореагувало 20 % речовини A.
відповідно рівні 0,5 моль/л і 0,2 моль/л. Розрахуйте константу рівноваги якщо в момент встановлення рівноваги прореагувало 20 % речовини A.
30. Розрахуйте процент розкладу молекулярного хлору на атоми, якщо константа рівноваги рівна 4,2.10-4, а вихідна концентрація хлору – 0,04 моль/л.
31. Розрахуйте масову частку купрум (ІІ) сульфату в розчині, утвореному при розчиненні 25 г кристалогідрату 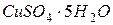 в 175 грамах води.
в 175 грамах води.
32. При випаровуванні з 25 розчину одержано 2 г солі. Чому рівна масова частка солі в розчині?
33. Для соління огірків використовують розчин кухонної солі з масовою часткою солі рівною 6 %. Скільки грамів води і солі потрібно для приготування 5 кг такого розчину?
34. 50 г забрудненої солі розчинили в 120 г води. При цьому одержали розчин з масовою часткою, рівною 25 %. Скільки грамів в нерозчинних речовин було в солі?
35. До 500 г розчину сульфатної кислоти з масовою часткою, рівною 10 % додали 0,5 л води. Чому рівна масова частка (%) кислоти в отриманому розчині?
36. Скільки грамів води треба додати до 30 г солі, щоб одержати розчин з масовою часткою, рівною 15 %?
37. До 30 г розчину з масовою часткою солі рівною 15 % додали 20г води. Чому рівна масова частка (%) солі в розчині?
38. Розрахуйте масову частку лугу в розчині, одержаного при взаємодії 69 г натрію з 224 г води.
39. До 40 г технічного калій гідроксиду, що містить 85 % КОН, додали 200 г води. Чому рівна масова частка KOH в розчині?
40. До 400 г розчину сірчаної (сульфатної) кислоти з масовою часткою, рівною 25 % долили 150 мл води. Чому рівна масова частка кислоти в одержаному розчині?
41. Розрахуйте молярність, нормальність і моляльність розчину з масовою часткою 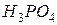 рівною 6 %
рівною 6 % 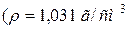 ).
).
42. Який об’єм 0,5 н. розчину будь-якої кислоти необхідно для нейтралізації розчину, що містить 0,2 г натрій гідроксиду?
43. Чому рівна масова частка KOH в 1,95 н. розчині калій гідроксиду (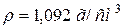 )?
)?
44. Скільки грамів мідного купоросу 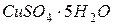 необхідно для приготування 5 л 0,1 н. розчину купрум сульфату?
необхідно для приготування 5 л 0,1 н. розчину купрум сульфату?
45. Скільки мілілітрів розчину з масовою часткою рівною 96 % сірчаної (сульфатної) кислоти (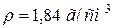 ) необхідно для приготування 3 л 0,4 н. розчину?
) необхідно для приготування 3 л 0,4 н. розчину?
46. Скільки мілілітрів розчину з масовою часткою, рівною 20 % HCl (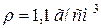 ) необхідно взяти для приготування 1 л розчину з масовою часткою, рівною 10 % (
) необхідно взяти для приготування 1 л розчину з масовою часткою, рівною 10 % (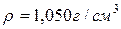 )?
)?
47. До 1 л розчину з масовою часткою, рівною 10 % KOH (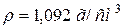 ) додали 0,5 л розчину з масовою часткою, рівною 5 % KOH (
) додали 0,5 л розчину з масовою часткою, рівною 5 % KOH (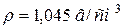 ). Розрахуйте масову частку KOH в одержаному розчині.
). Розрахуйте масову частку KOH в одержаному розчині.
48. До 3 л води прилили 1 л розчину з масовою часткою, рівною 30 % натрій гідроксиду (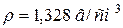 ). Розрахуйте масову частку натрій гідроксиду в одержаному розчині?
). Розрахуйте масову частку натрій гідроксиду в одержаному розчині?
49. Розрахуйте молярність розчину з масовою часткою, рівною 5 % сульфатної кислоти (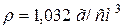 ). Скільки мілілітрів цього розчину піде на нейтралізацію 200 мл 0,5 н. розчину KOH?
). Скільки мілілітрів цього розчину піде на нейтралізацію 200 мл 0,5 н. розчину KOH?
50. Змішали 1 л розчину з масовою часткою, рівною 10 % HNO3 (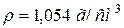 ) і 2 л розчину з масовою часткою, рівною 2 % цієї ж кислоти (
) і 2 л розчину з масовою часткою, рівною 2 % цієї ж кислоти (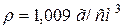 ). Чому рівна масова частка азотної (нітратної) кислоти в одержаному розчині?
). Чому рівна масова частка азотної (нітратної) кислоти в одержаному розчині?
51. На нейтралізацію 50 мл розчину KOH затратили 100 мл розчину з масовою часткою, рівною 6 % HCl 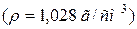 . Розрахуйте нормальність розчину KOH.
. Розрахуйте нормальність розчину KOH.
52. Змішали 100 мл розчину з масовою часткою, рівною 8 % арґентум нітрату (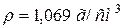 ) і 50 мл 1 н. розчину натрій хлориду. Скільки грамів осаду утворилось? Яка кількість і якої речовини взята в надлишку?
) і 50 мл 1 н. розчину натрій хлориду. Скільки грамів осаду утворилось? Яка кількість і якої речовини взята в надлишку?
53. Скільки грамів натрій гідроксиду міститься в розчині, якщо на нейтралізацію його затратили 25 мл 0,5 н. розчину HCl?
54. Яка речовина і в якій кількості залишиться в надлишку, якщо до 100 мл 0,1 н. розчину соляної (хлоридної) кислоти прилити 50 мл 0,5 н. розчину KOH?
55. Який об’єм води треба прилити до 1 л розчину з масовою часткою, рівною 12 % натрій гідроксиду (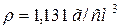 ), щоб одержати 2 н. розчин?
), щоб одержати 2 н. розчин?
56. Який об’єм 0,5 н. розчину кислоти треба для нейтралізації розчину, що містить 5,6 г KOH?
57. Змішали 1 л розчину з масовою часткою, рівною 5 % оцтової (ацетатної) кислоти (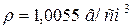 ), з 2 літрами розчину з масовою часткою, рівною 10 % цієї ж кислоти (
), з 2 літрами розчину з масовою часткою, рівною 10 % цієї ж кислоти (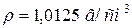 ). Розрахуйте молярність одержаного розчину, якщо його густина рівна (
). Розрахуйте молярність одержаного розчину, якщо його густина рівна (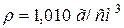 ).
).
58. Розрахуйте молярність розчину з масовою часткою, рівною 10 % Na2SO4 (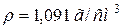 ).
).
59. Розрахуйте нормальність розчину з масовою часткою, рівною 20 % CaCl2 (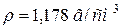 ).
).
60. Який об’єм води треба прилити до 1 л розчину з масовою часткою, рівною 20 % K2CO3 (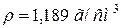 ) для приготування 1 н. розчину?
) для приготування 1 н. розчину?
61. Розрахуйте температури кристалізації і кипіння розчину з масовою часткою, рівною 2 % глюкози C6H12O6, якщо для води 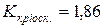 ;
; 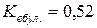 .
.
62. Розчин, що містить 11,04 г гліцерину в 800 г води, кристалізується при 0,279 °С. Розрахуйте молярну масу гліцерину, якщо для води 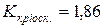 .
.
63. Скільки грамів цукру C12H22O11 розчинено в 1600 г H2O, якщо розчин закипає при 100,2 °С?
64. Розрахуйте температуру кристалізації розчину з масовою часткою рівною 5% етиленгліколю C2H4(OH)2 (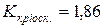 ).
).
65. Розрахуйте молярну масу речовини, якщо розчин, що містить 0,75 г цієї речовини в 250 г води, кристалізується при –0,093 °С (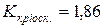 ).
).
66. Розрахуйте масову частку цукру у водному розчині, якщо температура кристалізації його рівна –0,465 °С. (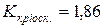 ).
).
67. Чому рівна масова частка гліцерину у водному розчині, якщо він закипає при 100,39 °С (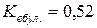 )?
)?
68. Розрахуйте температуру кристалізації 40 %-ного розчину етилового спирту C2H5OH, якщо 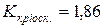 .
.
69. При розчиненні 4,6 г деякого неелектроліту в 250 г води температура кристалізації знижується на 0,372°. Розрахуйте молярну масу розчиненої речовини, якщо кріоскопічна константа води 1,86.
70. Температура кипіння етилового спирту (етанолу) 78,3 °С і 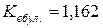 . Розрахуйте, скільки атомів входить до складу молекули йоду в розчиненому виді, якщо розчин, що містить 6,57 г йоду в 100 г спирту, закипає при 78,6 °С.
. Розрахуйте, скільки атомів входить до складу молекули йоду в розчиненому виді, якщо розчин, що містить 6,57 г йоду в 100 г спирту, закипає при 78,6 °С.
71. Температура кипіння розчину 12,8 г сірки в 250 мл бензину (Кебул= 1,162) на 0,12о вища, ніж в розчинника. Скільки атомів сульфуру містить молекула цієї речовини?
72. Розрахуйте ступінь дисоціації розчину з масовою часткою, рівною 4 % калій хлориду, якщо цей розчин замерзає при -2 °С (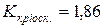 ).
).
73. При якій температурі замерзне 0,25 н. розчин NaOH, густина якого рівна 1,01 г/см3, а ступінь дисоціації 0,8 (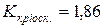 )?
)?
74. Ступінь дисоціації розчину азотної кислоти, що містить 31,5 г HNO3 в 500 г води, рівний 80 %. При якій температурі замерзне цей розчин (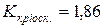 )?
)?
75. Розрахуйте температуру кипіння розчину, що містить 34 г BaCl2 в 1000 г води, якщо 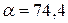 %, а
%, а 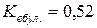 .
.
76. Чому рівний ізотонічний коефіцієнт для розчину K2SO4, що містить 48,5 г солі на 500 г води? Розчин замерзає при –1,83 °С (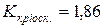 ).
).
77. Температура замерзання розчину, що містить 0,1 моля електроліту і 500 г води, рівна –0,67 °С, а ступінь дисоціації рівний 0,90. На скільки йонів дисоціює молекула електроліту?
78. При якій температурі закипить розчин, що містить 30 г NaOH і 250 г води, якщо ступінь дисоціації його рівний 0,70?
79. Розчин 8,585 г натрій нітрату в 100 г води замерзає при –3,04 оС. Розрахуйте ступінь дисоціації в цьому розчині.
80. Чому рівний ізотонічний коефіцієнт для розчину магній хлориду, що містить 0,1 моля солі в 1000 г води, якщо цей розчин замерзає при -0,461 °С?
81. Розчин 2,1г калій гідроксиду в 250 г води замерзає при –0,519 °С. Знайдіть величини ізотонічного коефіцієнта для цього розчину.
82. Температура кипіння розчину, що містить 9,09 калій нітрату в 100 г води, рівна 100,8 °С. Розрахуйте ступінь дисоціації солі в цьому розчині.
83. Розчин, що містить 0,53 г натрій карбонату в 200 г води, замерзає при –0,13 °С. Розрахуйте ступінь дисоціації соди в розчині.
84. Розчин, що містить 0,834 г натрій сульфату в 100 г води, замерзає при –0,028 °С. Розрахуйте ізотонічний коефіцієнт розчину.
85. Розчин 0,53 г натрій карбонату в 200 г води замерзає при –0,13 °С. Розрахуйте ізотонічний коефіцієнт розчину.
86. Розрахуйте температуру кипіння розчину 34 г барій хлориду в 1000 г води, якщо 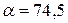 %, а
%, а 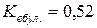 .
.
87. Уявний ступінь дисоціації розчину 2,925 г натрій хлориду в 50 г води рівний 0,8. При якій температурі розчин замерзне?
88. Уявні ступені дисоціації для 0,1 моль/л розчинів алюміній хлориду і калій хлориду приблизно однакові. Який з розчинів замерзне при більш низькій температурі? Чому?
89. Чому мінеральну воду дозволяється транспортувати при температурі 0 °С?
90. Розрахуйте температуру замерзання розчину, що містить 1 г арґентум нітрату в 50 г води, якщо уявний ступінь дисоціації солі рівний 89 %, а 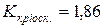 .
.
91. 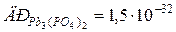 . Розрахуйте розчинність цієї солі в г/л і в моль/л.
. Розрахуйте розчинність цієї солі в г/л і в моль/л.
92. Як зміниться розчинність AgCl (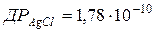 ) в 0,01 моль/л розчині натрій хлориду?
) в 0,01 моль/л розчині натрій хлориду?
93. У скільки разів менша розчинність CaC2O4 в 0,01 моль/л розчині (NH4)2C2O4, ніж у чистій воді (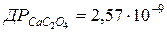 )?
)?
94. Розчинність Fe(OH)3 рівна 1,9 . 10-10моль/л. Розрахуйте 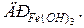
95. Розчинність CaCO3 при 35 °С рівна 6,9.10-5 моль/л. Розрахуйте добуток розчинності цієї солі.
96. Розрахуйте добуток розчинності плюмбум (ІІ) броміду, якщо розчинність цієї солі рівна 1,32.10-2 моль/л.
97. У скільки разів розчинність (в моль/л) Fe(OH)2 у воді більша за розчинність Fe(OH)3? 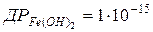 ;
; 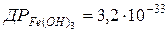 .
.
98. Скільки літрів води треба взяти, щоб розчинити 1 г купрум (ІІ) сульфіду, якщо 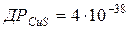 ?
?
99. В 300 мл насиченого розчину плюмбум йодиду міститься 81 мг йонів Pb2+. Розрахуйте 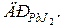
100. Чи випаде осад кальцій сульфату, якщо змішати рівні об’єми 0,02 н. розчинів кальцій хлориду і натрій сульфату (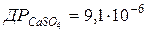 )?
)?
101. До 50 мл 0,001 н. розчину HCl долили 450 мл 0,0001 н. розчину AgNO3. Чи випаде осад арґентум хлориду (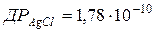 )?
)?
102. Чи утвориться осад арґентум сульфату, якщо до 0,02 моль/л розчину арґентум нітрату додати рівний об’єм 0,1 н. розчину сульфатної кислоти (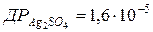 )?
)?
103. До 100 мл 0,01 моль/л розчину кальцій хлориду додали 400 мл 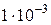 моль/л розчину калій сульфату. Чи випаде осад кальцій сульфату, якщо
моль/л розчину калій сульфату. Чи випаде осад кальцій сульфату, якщо 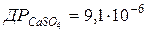 ?
?
104. 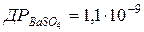 . Яка розчинність у г/л цієї солі?
. Яка розчинність у г/л цієї солі?
105. 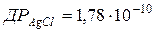 . Яка розчинність у г/л і в моль /л цієї солі?
. Яка розчинність у г/л і в моль /л цієї солі?
106. У 200 мл води розчиняється 0,106 г MgCO3. Розрахуйте 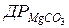 .
.
107. Розрахуйте розчинність PbSO4 в моль/л у 0,01 моль/л розчині натрій сульфату, якщо 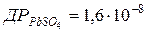 .
.
108. Розрахуйте розчинність у моль/л кальцій карбонату в 0,1моль/л розчині Na2CO3, якщо 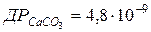 .
.
109. У скільки разів розчинність (моль/л) AgCl в 0,001 н. розчині NaCl менша, ніж у воді (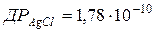 )?
)?
110. Скільки літрів води необхідно для розчинення 1 г BaCO3 (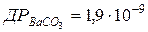 )?
)?
111. 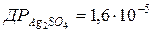 . Розрахуйте розчинність цієї солі у воді в моль/л.
. Розрахуйте розчинність цієї солі у воді в моль/л.
112. 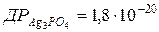 . Розрахуйте розчинність цієї солі у воді в г/л.
. Розрахуйте розчинність цієї солі у воді в г/л.
113. Скільки літрів води необхідно для розчинення 10 г Ca(OH)2? ( ).
).
114. Скільки грамів MgCO3 розчиняється в 1 л води? 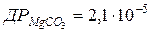 .
.
115. Скільки грамів цинк гідроксиду розчиняється в 1 л води? 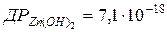 .
.
116. Скільки літрів води необхідно взяти для розчинення 1 г Cu(OH)2? 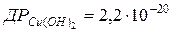 .
.
117. Розрахуйте розчинність йодиду арґентуму в насиченому розчині в г/л. 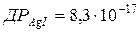 .
.
118. 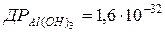 . Яка розчинність у г/л алюміній гідроксиду?
. Яка розчинність у г/л алюміній гідроксиду?
119. У скількох літрах води розчиняється 100 г CaCO3? 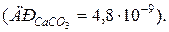
120. 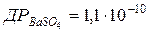 .Чи випаде осад при змішуванні 50 мл 10-3 моль/л розчину BaCl2 і 950 мл 10-5 моль/л розчину H2SO4?
.Чи випаде осад при змішуванні 50 мл 10-3 моль/л розчину BaCl2 і 950 мл 10-5 моль/л розчину H2SO4?
121. Розрахуйте молярність розчину оцтової (ацетатної) кислоти, pH якого рівний 3. (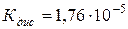 ).
).
122. В 400 мл розчину міститься 0,56 г KOH. Розрахуйте pH і pOH розчину.
123. Розрахуйте pH розчину з масовою часткою, рівною 4 % азотної (нітратної) кислоти (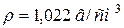 ).
).
124. В 400 мл розчину міститься 0,16 г NaOH. Розрахуйте pH розчину.
125. pH мурашиної (форміатної) кислоти рівний 2. Чому рівна молярність розчину кислоти (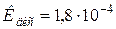 )?
)?
126. Розрахуйте pH розчину з масовою часткою, рівною 10 % NH4OH, якщо 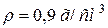 і
і 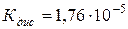 .
.
127. pH розчину оцтової (ацетатної) кислоти рівний 4. 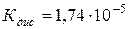 . Чому рівна нормальність розчину?
. Чому рівна нормальність розчину?
128. До 250 мл води додали 50 мл розчину з масовою часткою, рівною 8 % KOH (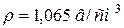 ). Розрахуйте pH одержаного розчину.
). Розрахуйте pH одержаного розчину.
129. рН розчину КОН рівний 10. Чому рівна нормальність розчину?
130. Розрахуйте нормальність розчину ацетатної кислоти, якщо рН його рівний 4 (Кдис= 1,74.10-5).
131. рН розчину хлоридної кислоти рівний 1. Чому рівна молярність розчину?
132. Розрахуйте рН розчину хлоридної кислоти, 200 мл якого містять 0,365 г HCl.
133. До 200 мл розчину з масовою часткою, рівною 10 % NaOH (r = 1,11 г/см3) додали 300 мл води. Густина отриманого розчину рівна 1,043 г/см3. Розрахуйте рН одержаного розчину.
134. Розрахуйте рН розчину, в 1 л якого міститься 0,4 г NaOH.
135. Розрахуйте рН розчину з масовою часткою, рівною 3,12 % хлоридної кислоти.
136. Чому рівний рН 0,001 н. розчину NH4OH, якщо Кдис = 1,76.10-5?
137. Концентрація йонів гідрогену в розчині рівна 1.10-4 моль/л. Чому рівний рН і рОН розчину?
138. рН розчину кислоти рівний 2. Яка молярна концентрація йонів гідрогену в розчині?
139. рН розчину сульфатної кислоти рівний 3. Яка масова частка кислоти (в %) в розчині, якщо r = 1,005 г/см3?
140. Чому рівний рН розчину з масовою часткою, рівною4 % нітратної кислоти, якщо r = 1,020 г/см3?
141. До 60 мл розчину з масовою часткою, рівною 1 % сульфатної кислоти (r = 1,005 г/см3) прилили 340 мл води. Чому рівний рН отриманого розчину?
142. До 450 мл води прилили 50 мл 0,1 моль/л розчину сульфатної кислоти. Чому рівний рН отриманого розчину?
143. Змішали 500 мл 0,05М і 1500 мл 0,5 М розчинів нітратної кислоти. Чому рівний рН отриманого розчину?
144. Чому рівний рН розчину хлоридної кислоти, якщо в 500 мл цього розчину міститься 0,183 г HCl?
145. Молярна концентрація іонів гідрогену в розчині нітратної кислоти рівна 1.10-4 моль/л. Чому рівна молярність розчину, якщо Кдис = 5,1.10-4?
146. У скільки разів концентрація йонів гідрогену більша в 0,1 моль/л розчині хлоридної кислоти, ніж в 0,1 моль/л розчині хлоратної (І) кислоти (Кдис = 1,4.10-3)?
147. Молярність розчинів хлоридної і ацетатної кислот рівні 1.10-2 моль/л. Розчин якої кислоти є більш кислим (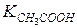 = 1,76.10-5)?
= 1,76.10-5)?
148. рН розчину сульфатної кислоти рівний 1. Чому рівна молярна концентрація йонів гідрогену в розчині?
149. рН розчину ціанідної кислоти HCN рівний 2. Яка молярність розчину, якщо Кдис = 6,2.10-10?
150. рН розчину лугу рівний 10. Чому рівна молярна концентрація гідроксид-йонів в розчині?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1084; Нарушение авторских прав?; Мы поможем в написании вашей работы!