
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Завдання. 1. На нейтралізацію розчину КОН затрачено 25 мл 0,1 н
1. На нейтралізацію розчину КОН затрачено 25 мл 0,1 н. розчину НСl. Скільки грамів КОН містилося в розчині?
2. До розчину H2SO4 додали 20,5 мл 0,2 н. розчину КОН, після цього середовище стало нейтральним. Скільки грамів H2SO4 було в розчині?
3. Скільки грамів NaOH міститься в розчині, якщо на його нейтралізацію затратили 22,40 мл 1,5 н. розчину НСl?
4. Скільки грамів H2SO4 міститься в розчині, на нейтралізацію якого витрачено 15,5 мл 0,3 н. КОН?
5. Скільки мл 2 н. розчину NaOH необхідно для нейтралізації розчину, що містить 4,9 г H2SO4?
6. Скільки мілілітрів 0,1 н. розчину НСl треба затратити на нейтралізацію розчину, що містить 1,00 г NaOH?
7. До розчину, що містить 0,5 г КОН, додали 10 мл 1 н. розчину H2SO4. Луг чи кислоту взято в надлишку?
8. До розчину, що містить 1,00 г H2SO4, додали 10 мл 2 н. NaOH. Яке за характером середовище одержаного розчину? Яка речовина і в якій кількості взята в надлишку?
9. На нейтралізацію розчину, що містить 1,0 г технічного натрій гідроксиду, затратили 20 мл 0,1 н. розчину НСl. Обчислити процентний вміст NaOH в зразку.
10. На нейтралізацію 1,00 г технічної сірчаної (сульфатної) кислоти затрачено 10 мл 2 н. розчину КОН. Обчислити процентний вміст H2SO4 в технічній кислоті.
11. До 25 мл розчину соляної (хлоридної) кислоти додали 25 мл 0,1 н. розчину NaOH. При цьому середовище стало нейтральним. Чому рівна нормальність розчину кислоти?
12. Змішали 50 мл розчину КОН і 100 мл 0,2 н. розчину НСl. Яка нормальність розчину КОН, якщо після змішування розчинів середовище стало нейтральним?
13. 50 мл розчину H2SO4 реагує повністю з 45,65 мл 0,1 н. розчину NaOH. Чому рівна нормальність розчину сульфатної кислоти?
14. На нейтралізацію 25 мл розчину КОН затрачено 20,50 мл 0,2 н. розчину НСl. Чому рівна нормальність розчину КОН?
15. 25 мл розчину кислоти нейтралізують 20 мл розчину лугу. Чому рівне відношення нормальності розчину кислоти до нормальності розчину лугу?
16. З 20,00 мл розчину КОН повністю реагують з 15,00 мл розчину H2SO4 . В якому співвідношенні знаходяться між собою нормальності КОН і H2SO4?
17. Який об’єм 0,2 н. розчину НСl необхідний для нейтралізації 40 мл 0,1 н. розчину NaOH?
18. Який об’єм 0,1 н. H2SO4 необхідно взяти для нейтралізації 25 мл 0,15 н. розчину K2CO3?
19. На нейтралізацію 25,00 мл 0,1125 н. розчину НСl затратили 28,5 мл КОН. Яка нормальність розчину КОН?
20. На нейтралізацію 25,00 мл розчину NaOH затратили 22,6 мл 0,965 н. розчину НСl. Визначити нормальність розчину NaOH.
21. Скільки мілілітрів розчину, що містить 3,65 г НСl в 1 л, необхідно затратити на нейтралізацію 25,00 мл розчину, в якому міститься 4 г NaOH в 1 л?
22. До 10,00 г 25 %-ного розчину КОН долили 10,00 г 25 %-ного розчину H2SO4. Яке середовище має утворений розчин?
23. Злили рівні об’єми 20 %-них розчинів КОН і НСl. Яке середовище одержаного розчину?
24. Наважку Na2CO3 (х.ч.) 1,3540 г розчинили в мірній колбі на 250 мл, розчин довели до мітки. Чому рівний титр розчину?
25. Скільки грамів NaOH міститься в 250 мл розчину, титр якого рівний 0,004120 г/мл?
26. На титрування кислоти затратили 18,54 мл розчину NaOH, титр якого 0,003980 г/мл. Скільки грамів NaOH вступило в реакцію з кислотою?
27. Титр розчину NaOH 0,04000 г/мл. Обчислити нормальність розчину.
28. Титр розчину НСl становить 0,03647 г/мл. Обчислити нормальність розчину.
29. Розчин містить 2,3640 г КОН в 1 л. Обчислити титр розчину.
30. На титрування соляної (хлоридної) кислоти затратили 10,00 мл робочого розчину NaOH з титром Т =0,003874 г/мл. Скільки грамів НСl містилося в розчині?
31. В розчині 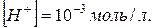 Обчислити pH.
Обчислити pH.
32. В розчині 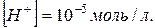 Обчислити pH.
Обчислити pH.
33. В розчині  Обчислити pH.
Обчислити pH.
34. В розчині  Обчислити pH.
Обчислити pH.
35. В розчині  Обчислити pH.
Обчислити pH.
36. В розчині  Обчислити pH.
Обчислити pH.
37. В розчині  Обчислити pH.
Обчислити pH.
38. В розчині  Обчислити pH.
Обчислити pH.
39. В розчині  Обчислити pH.
Обчислити pH.
40. В розчині 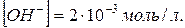 Обчислити pH.
Обчислити pH.
41. Обчислити pH 0,05 М розчину HCl.
42. Обчислити pH 0,01 М розчину NaOH.
43. Обчислити pH 0,01 М розчину KOH.
44. Обчислити pH 0,0005 М розчину HNO3.
45. Обчислити pH 0,0005 М розчину H2SO4.
46. Обчислити pH 0,0005 М розчину Ca(OH)2 (a  100%).
100%).
47. Обчислити pH 0,05 М розчину KOH.
48. Обчислити pH 0,01 М розчину HCl.
49. Обчислити pH 0,001 М розчину H2SO4.
50. Обчислити pH 0,001 М розчину HNO3.
51. До 20 мл 0,04 н. HCl додали 45 мл 0,02 н. KOH. Знайти pH одержаного розчину.
52. До 50 мл 0,01 н. H2SO4 додали 15 мл 0,5 н. NaOH. Знайти pH одержаного розчину.
53. До 15 мл 0,1 н. HCl додали 10 мл 0,15 н. розчину NaOH. Знайти pH одержаного розчину.
54. До 25 мл 0,02 н. H2SO4 додали 30 мл 0,015 н. NaOH. Знайти pH одержаного розчину.
55. Обчислити 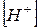 в розчині, якщо pH 2,6.
в розчині, якщо pH 2,6.
56. Обчислити 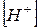 в розчині, якщо pH 5,2.
в розчині, якщо pH 5,2.
57. Обчислити 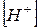 в розчині, якщо pH 8.
в розчині, якщо pH 8.
58. Обчислити 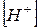 в розчині, якщо pH 9.
в розчині, якщо pH 9.
59. Обчислити 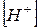 в розчині, якщо pH 12.
в розчині, якщо pH 12.
60. Обчислити 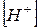 в розчині, якщо pH 0.
в розчині, якщо pH 0.
61. Обчислити еквівалентні маси KMnO4 в кислому, нейтральному і лужному середовищах.
62. Скільки грамів KMnO4 потрібно для приготування 750 мл 0,1 н. розчину?
63. Скільки грамів KMnO4 потрібно для приготування 1,5 л 0,05 н. розчину?
64. Скільки грамів H2C2O4 . 2H2O (х.ч.) потрібно взяти для приготування 500 мл 0,05 н. розчину?
65. Наважка 1,2540 г H2C2O4 . 2H2O (х.ч.) розчинена в мірній колбі на 250 мл. Чому рівний титр розчину?
66. На титрування 20,00 мл розчину щавлевої кислоти затратили 25,00 мл розчину KMnO4 в сірчанокислому середовищі. TKMnO4 = 0,003350 г/мл. Чому рівна нормальність розчину щавлевої кислоти?
67. Наважку 1,2500 г щавлевої кислоти розчинили в мірній колбі на 250 мл. На титрування 25,00 цього розчину затратили 21,20 мл розчину KMnO4. Визначити нормальність розчинів.
68. На титрування розчину FeSO4 витратили 21,60 мл KMnO4. TKMnO4 = 0,002852 г/мл. Скільки грамів FeSO4 в розчині?
69. 1,1500 г розчину пероксиду водню розвели водою в мірній колбі на 250 мл. На титрування 25,00 мл цього розчину затратили 30,25 мл 0,05 н. розчину KMnO4. Обчислити процентний вміст пероксиду водню в розчині.
70. Наважка 0,3745 г щавлевої кислоти розчинена у воді і відтитрована калій перманганатом. При цьому затратили 38,42 мл 0,05 н. розчину KMnO4. Обчислити процентний вміст щавлевої кислоти H2C2O4 в зразку.
71. Скільки грамів йоду J2 (х.ч.) потрібно для приготування 250 мл 0,05 н. розчину?
72. Скільки грамів йоду J2 (х.ч.) потрібно для приготування 500 мл розчину з  = 0,005876 г/мл?
= 0,005876 г/мл?
73. Скільки грамів натрій тіосульфату Na2S2O3.5H2O потрібно для 2500 мл 0,05 н. розчину?
74. Скільки грамів калій біхромату (х.ч.) потрібно для приготування 250 мл 0,05 н. розчину?
75. Яку наважку калій біхромату потрібно взяти на аналітичних вагах для приготування 500 мл 0,1 н. розчину?
76. Для стандартизації ~ 0,1 н. розчину Na2S2O3 методом окремих наважок взяли 0,1190 г калій біхромату. Чи достатній для титрування об’єм бюретки на 50 мл?
77. Наважку молекулярного йоду (х.ч.) 2,9840 г розчинили в мірній колбі на 50 мл. Знайти нормальність розчину.
78. Наважка K2Cr2O7 (х.ч.) 0,1180 г в кислому середовищі оброблена йодидом калію і відтитрована розчином натрій тіосульфату. При цьому затратили 23,80 мл розчину натрій тіосульфату. Чому рівний титр розчину натрій тіосульфату?
79. На титрування йоду, що утворюється з розчину калій йодиду при взаємодії з 0,1154 г калій біхроматом в сульфатнокислому середовищі, витрачається 23,74 мл розчину натрій тіосульфату. Знайти нормальність розчину Na2S2O3.
80. Наважку натрій сульфіту масою 7,3460 г розчинили у воді. На титрування 20,00 мл розчину йоду з нормальністю  н. затратили 23,15 мл розчину натрій сульфіту. Обчисліть процентний вміст Na2SO3 в досліджуваному зразку.
н. затратили 23,15 мл розчину натрій сульфіту. Обчисліть процентний вміст Na2SO3 в досліджуваному зразку.
81. Наважку натрій сульфіду масою 0,0902 г розчинили у воді і відтитрували розчином йоду. При цьому затратили 18,20 мл розчину йоду з титром T = 0,03120 г/мл. Обчисліть процентний вміст Na2S у досліджуваному препараті.
82. До 20,00 мл 0,1086 н. розчину йоду додали 45,00 мл 0,0493 н. розчину натрій тіосульфату, після цього додали 1 мл розчину крохмалю. Синім чи прозорим буде розчин?
83. До розчину, одержаного при розчиненні 0,1432 г K2Cr2O7, додали кислоту, калій йодид, крохмаль і 25,00 мл 0,1101 н. розчину натрій тіосульфату. Знебарвиться розчин чи буде синім?
84. 1,2620 г йоду розчинили в мірній колбі на 250 мл. Розрахувати титр і нормальність цього розчину.
85. До 10,00 мл сірководневої води (розчину сульфідної кислоти) додали 50,00 мл 0,1112 н. розчину йоду, на титрування залишку йоду затратили 32,79 мл 0,0973 н. розчину натрій тіосульфату. Яка масова частка сірководню в розчині?
86. До розчину калій біхромату додали надлишок KJ і виділений йод відтитрували 48,00 мл 0,1000 н. Na2S2O3. Скільки грамів K2Cr2O7 містилося в розчині?
87. До наважки 0,1500 г K2Cr2O7 додали KJ і сульфатну кислоту. Йод, що виділився, відтитрували 21,65 мл розчину натрій тіосульфату. Розрахувати нормальну концентрацію розчину натрій тіосульфату.
88. Скільки грамів HCl міститься в 200 мл розчину технічної соляної кислоти, якщо на титрування J2, виділеного при взаємодії 20,00 мл розчину кислоти з надлишком суміші KJO3 і KJ, затратили 18,25 мл 0,02 н. розчину Na2S2O3?
89. Сірку, що містилася в 0,1906 г вугілля, окисленням перевели в SO2. Одержаний сульфур (IV) оксид поглинули водним розчином крохмалю і відтитрували 20,45 мл 0,02088 н. розчином J2. Обчисліть масову частку (%) сірки в вугіллі.
90. Скільки грамів калій біхромату (х.ч.) потрібно для приготування 1 л 0,0500 н. розчину?
91. Скільки грамів арґентум нітрату, що містить 3,98 % домішок, необхідно зважити для приготування 250 мл 0,025 н. розчину цієї солі?
92. Наважку KCl (х.ч.) масою 1,4960 г розчинили в колбі на 200 мл. Скільки мілілітрів 0,1000 н. розчину AgNO3 затратиться на титрування 20,00 мл розчину калій хлориду?
93. З наважки натрій хлориду масою 0,8142 г приготували 250 мл розчину. Скільки мілілітрів 0,0500 н. розчину AgNO3 необхідно затратити на титрування 25,00 мл розчину NaCl?
94. Скільки мілілітрів 0,0500 н. розчину AgNO3 необхідно затратити на титрування 20,00 мл розчину, одержаного розчиненням 1,1820 г NaCl у мірній колбі на 250 мл?
95. Скільки мілілітрів розчину AgNO3 з титром Т = 0,01760 г/мл затрачається на титрування 25,00 мл розчину, одержаного розчиненням 1,1820 г NaCl у мірній колбі на 250 мл?
96. Скільки мілілітрів 0,0500 н. розчину AgNO3 затрачається на титрування 20,00 мл розчину калій хлориду, одержаного розчиненням 0,9312 г KCl у мірній колбі на 250 мл?
97. Наважку 0,8180 г зразка суміші натрій хлориду і нітрату розчинили в мірній колбі ємністю 200 мл. На титрування 20,00 мл цього розчину затратили 18,35 мл розчину AgNO3 з титром Т = 0,07854 г/мл. Який процентний вміст NaCl у досліджуваному зразку?
98. 10 мл розсолу розвели в мірній колбі до 500 мл. На титрування 25,00 мл цього розчину затратили 24,95 мл розчину AgNO3 з титром Т = 0,008059 г/мл. Скільки грамів натрій хлориду міститься в 1 л розсолу?
99. Наважку KCl (х.ч.) масою 3,8460 г розчинили в мірній колбі на 500 мл. На титрування 20,00 мл цього розчину витрачається 18,40 мл розчину арґентум нітрату. Розрахуйте нормальність розчину AgNO3?
100. На титрування розчину, що приготували розчиненням 0,1020 г NaCl у воді, затрачається 38,40 мл розчину арґентум нітрату. Розрахуйте еквівалентну концентрацію розчину AgNO3.
101. На титрування 25,00 мл розчину NaCl у воді затрачається 24,30 мл розчину арґентум нітрату. Розрахуйте еквівалентну концентрацію і титр розчину AgNO3, якщо титр розчину хлориду натрію рівний Т = 0,003115 г/мл.
102. Наважку суміші натрій хлориду і нітрату масою 0,9000 г розчинили в мірній колбі на 200 мл. На титрування 320,00 мл цього розчину затратили 18,35 мл розчину AgNO3 з титром  0,003442 г/мл. Обчисліть процентний вміст NaCl в суміші.
0,003442 г/мл. Обчисліть процентний вміст NaCl в суміші.
103. Скільки грамів HCl міститься в 1 л розчину, якщо 25,00 мл цього розчину нейтралізували і розвели водою в мірній колбі на 250 мл? На титрування одержаного розчину витрачається 24,37 мл 0,0985 н. розчину AgNO3.
104. При визначенні вмісту натрій хлориду 0,2 г зразка розчинили у воді і відтитрували 21,20 мл 0,0500 н. розчину AgNO3. Обчисліть процентний вміст натрій хлориду в зразку.
105. 10 г розсолу помістили в мірну колбу на 100 мл і довели до мітки водою. 10,00 мл одержаного розчину від титрували 20,10 мл 0,0500 н. розчину AgNO3. Обчисліть процентний вміст кухонної солі в розсолі.
106. Скільки грамів трилону Б необхідно взяти для приготування 5 л 0,05 н. розчину?
107. Яка загальна твердість води, якщо при її визначенні на 100 мл води затратили 14,00 мл 0,0500 н. розчину трилону Б?
108. Скільки грамів трилону Б необхідно відважити для приготування 2,5 л 0,1 н. розчину, якщо вихідний зразок містить 0,1 % домішок?
109. На титрування 20,00 мл розчину, приготованого з 1,5250 г безводного магній сульфату в мірній колбі на 500 мл, затрачається 19,55 мл розчину трилону Б. Яка нормальність робочого розчину трилону Б?
110. На титрування 100 мл твердої води затратили 10,60 мл 0,0500 н. розчину трилону Б. Чому рівна загальна твердість води?
111. При титруванні за методом нейтралізації було встановлено, що тимчасова твердість води рівна 3,5 мекв/л. Чому рівна загальна і постійна твердість води, якщо на титрування 100 мл цієї води затрачається 12,00 мл 0,05 н. розчину трилону Б?
112. Загальна твердість води, визначена трилонометрично, рівна 6,0 мекв/л. Чому рівна постійна твердість води, якщо на титрування 100 мл води затратили 7,00 мл 0,05 н. розчину HCl в присутності метилового оранжевого?
113. Скільки грамів магній сульфату необхідно для приготування 250 мл 0,05 н. розчину?
114. Чому рівна загальна твердість води, якщо постійна дорівнює 5,0 мекв/л, а на титрування 100 мл цієї води затратили 5,2 мл 0,05 н. розчину HCl в присутності метилоранжу?
115. На титрування 100 мл твердої води затратили 12,60 мл 0,0500 н. розчину трилону Б. Чому рівна загальна твердість води?
116. Скільки грамів трилону Б необхідно для приготування 2,5 л 0,05 н. розчину?
117. На титрування 10,00 мл 0,1000 н. розчину магній сульфату затратили 18,50 мл розчину трилону Б. Чому рівна нормальність розчину трилону Б і його титр за магнієм?
118. Скільки грамів магній сульфату міститься в 500 мл розчину, якщо на титрування його 10,00 мл затрачається 16,5 мл 0,0500 н. розчину трилону Б?
119. На титрування 100 мл твердої води затратили 7,4 мл 0,0500 н. розчину HCl, а на титрування 100 мл цієї ж води затратили 15,8 мл 0,0500 н. розчину трилону Б. Чому рівна загальна, тимчасова і постійна твердість води?
120. Скільки грамів трилону Б необхідно взяти для приготування 1 л 0,0500 н. розчину?
|
|
Дата добавления: 2015-05-24; Просмотров: 2431; Нарушение авторских прав?; Мы поможем в написании вашей работы!