
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості
|
|
|
|
Фізичні властивості
Способи добування
1. Галогенування алканів
Взаємодія алканів з галогенами проходить при УФ-опромінюванні. Метод дозволяє одержати хлор- і бромалкани. Недоліком цього способу є утворення суміші моно-, ди- та полігалогеналканів.
2. Приєднання галогеноводнів до алкенів
За допомогою цього методу можна одержати фтор-, хлор-, бром-та йодалкани.
3. Добування зі спиртів
При одержанні галогеналканів зі спиртів використовують галогеноводні (НС1, НВг, НІ), галогеніди фосфору (РС13, РСl5, РВr3, РВr5) і тіоніл-хлорид SОС12.
Взаємодія спиртів з галогеноводнями проходить за такою схемою:
С2Н5ОН + НВr ® С2Н5Вr.
За допомогою цієї реакції можна одержати хлор-, бром- та йодалкани.
З більш високими виходами галогеналкани утворюються при взаємодії спиртів з галогенідами фосфору (III) або фосфору (V), а також тіонілхлоридом:
3С2Н5ОН + РСІ3 ® 3С2Н5С1 + Н3РО3;
С2Н5ОН + РС15 ® С2Н5С1 + НСІ + РОСl3;
С2Н5ОН + SОСІ2 ® С2Н5С1 + НС1 + SО2.
Реакція з тіонілхлоридом дуже зручна тим, що всі побічні продукти є газоподібними речовинами та легко відходять з реакційного середовища.
За звичайних умов нижчі галогеналкани − безбарвні гази або рідини з своєрідним солодкуватим запахом, середні − рідини, вищі − тверді речовини Температура кипіння зростає зі збільшенням атомної маси галогену, числа атомів галогену (за виключенням фторпохідних) та довжиникарбонового ланцюга молекули. Нижчі галогеналкани| практично нерозчинні у воді, але легко розчиняються в органічнй розчинниках: Деякі з них самі є ефективними розчинниками. Багато з них мають наркотичну дію.
Галогеналкани є досить реакційноздатними речовинами. Найбільш характерні для них реакції нуклеофільного заміщення (SN) та відщеплення (Е). Крім того, вони вступають також у реакції відновлення та взаємодію з металами (металування).
А. Реакції нуклеофільного заміщення ( SN )
Галогеналкани є електрофільними реагентами внаслідок полярністі зв’язку С−НаІ зі зміщенням до атому галогену. В результаті атом галогену набуває часткового негативного (-d), а атом карбону − часткового позитивного (+d) заряду. Тому останній може взаємодіяти з нуклеофільним реагентом. У процесі атаки нуклеофіл надає пару електронів для утворення хімічного зв’язку з електронодефіцитним атомом карбону, а атом галогену відщеплюється від молекули галогеналкану:
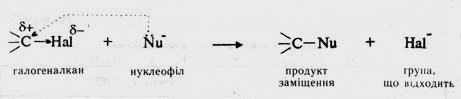
Таку реакцію називають реакцією нуклеофільного заміщення і позначають символом SN. Нуклеофільними реагентами можуть бути речовини, що містять у молекулах атоми з неподіленими парами електронів (NН3, R—NН2, НОН та ін.), або речовини, що утворюють при дисоціації аніони (нуклеофільні частинки): NаОН (ОН−), С2Н5ОNа (С2Н5О−), KСN (СN−), NаNО2 (NО2−), СН3СООNа (СН3СОО−), КВг (Вг−),та ін.
В результаті нуклеофільного заміщення в структуру нуклеофілу вводиться алкільний замісник, тобто відбувається алкілування нуклеофілу. Тому галогеналкани є алкілуючими реагентами.
Схильність галогеналканів до реакцій SN визначається полярністю з’язку С−Наl (статичний фактор). Не зважаючі на найбільшу полярність зв’язку С−F, реакційна здатність галогеналканів у реакціях SN зменшується в ряді: R−І > R−Вг > R−С1 > R−F, що пояснюється поляризовністю зв’язку С−Наl, тобто здатністю одатково поляризуватися при підході нуклеофільного реагенту (динамічний фактор). Відомо, поляризовність зв’язку тим більша, чим більш об’ємна та рухлива електронна оболонка атомів, які утворюють зв’язок. Серед галогенів найвищу поляризовність має атом йоду, найнижчу − атом фтору. Враховуючи низьку поляризовність зв’язку С− F, фторалкани практично не вступають у реакцію нуклеофільного заміщення. Активність решти галогеналканів у відношенні до нуклеофілів спадає в ряді: R−І > R−Вг > R−СІ.
У залежності від будови галогеналкану, природи нуклеофілу та розчинника реакції нуклеофільного заміщення проходять за двома основними механізмами: механізмом SN 1 та механізмом SN 2.
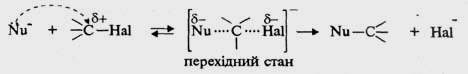 За механізмом SN2 (бімолекулярне нуклеофільне заміщення) реакція відбувається в одну стадію через утворення перехідного стану, у побудові якого бере участь як молекула галогеналкану, так і нуклеофільний реагент. Нуклеофіл атакує електрофільний центр молекули галогеналкану з боку, протилежного зв’язку С—НаІ (атака з тилу).
За механізмом SN2 (бімолекулярне нуклеофільне заміщення) реакція відбувається в одну стадію через утворення перехідного стану, у побудові якого бере участь як молекула галогеналкану, так і нуклеофільний реагент. Нуклеофіл атакує електрофільний центр молекули галогеналкану з боку, протилежного зв’язку С—НаІ (атака з тилу).
При зближенні нуклеофілу з галогеналканом утворюється перехідний стан − нестійке сполучення двох реагентів, який знаходиться у рівновазі з вихідними реагентами. Йому відповідає максимум на енергетичній діаграмі реакції. В міру дальшого зближення реагентів у перехідному стані відбувається синхронний процес розриву зв’язку С−НаІ та утворення зв’язку С−Nu. Швидкість реакцій, які проходять за механізмом SN 2, залежить від концентрації обох реагентів і описується кінетичним рівнянням другого порядку: v = k [R−Hal][Nu].
Фактори, які сприяють перебігу реакцій за механізмом SN 2.
Реакційна здатність галогеналканів за механізмом SN 2 тим вища, чим більший частковий позитивний заряд на атомі вуглецю, зв’язаному з галогеном. Тому серед первинних галогеналканів активність зменшується в ряді: метил-, етил-, пропил-похідні.
Значно більший вплив на реакційну здатність галогеналканів справляють просторові фактори. Чим більші кількість і об’єм замісників при атомі вуглецю, зв’язаному з галогеном, тим важче утворюється перехідний стан через просторові перешкоди. У зв’язку з цим за механізмом SN 2 легко реагують первинні, важче − вторинні галогеналкани. Третинні галогеналкани не вступають у реакції нуклеофільного заміщення за механізмом SN 2.
Вплив розчинника на ці процеси визначається механізмом сольватації. Протонні полярні розчинники − вода, спирти, мурашина кислота, ацетатна кислота та інші − добре сольватують як катіони, так і аніони. Сольватуючи нуклеофіл, вони знижують його реакційну здатність і відповідно уповільнюють реакції, що йдуть за механізмом SN 2. Апротонні полярні розчинники (диметилформамід НСОN(СН3)2, диметилсульфоксид (СН3)2SО, ацетон СН3СОСН3, ацетонітрил СН3−СºN та ін.) сольватують тільки катіони, через це швидкість реакцій SN 2 у них підвищується.
За механізмом SN 1 реакція проходить у дві стадії.
На стадії І відбувається іонізація молекули галогеналкану з утворенням карбкатіона та галогенід-іона. Процес іонізації проходить повільно, а через це він визначає швидкість усієї реакції. В іонізації галогеналкану надає допомогу розчинник.
На стадії II катіон, oо утворився, швидко взаємодіє з нуклеофільним реагентом, утворюючи кінцевий продукт реакції:
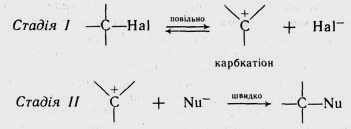 Механізм нуклеофільного заміщення, який здійснюється за розглянутою схемою, називається мономолеку-лярним, оскільки в стадії, що визначає швидкість усього процесу (стадія І), бере участь молекула тільки одного реагенту (галогеналкану). Такий механізм позначають SN 1.
Механізм нуклеофільного заміщення, який здійснюється за розглянутою схемою, називається мономолеку-лярним, оскільки в стадії, що визначає швидкість усього процесу (стадія І), бере участь молекула тільки одного реагенту (галогеналкану). Такий механізм позначають SN 1.
Швидкість реакцій, які проходять за таким механізмом, залежить тільки від концентрації галогеналкану, що описується кінетичним рівнянням першого порядку: v = k [R−Hal].
Фактори, що сприяють перебігу реакцій за механізмом SN 1.
1.Просторові перешкоди для атаки нуклеофілом електронодефіцитного атома Карбону;
2. Здатність сполук утворювати досить стійкі карбкатіони.
3. Висока іонізуюча та сольватуюча здатність розчинника.
За механізмом SN 1 відбувається нуклеофільне заміщення в третинних і за певних умов − у вторинних галогеналканів.
У молекулі третинного галогеналкану, наприклад трет-бутил-броміду (СН3)3С−Вг, три метильні групи утворюють просторову перешкоду для підходу нуклеофілу до електрофільного центру і, відповідно, його атака з тилу стає неможливою. Крім того, третинні галогеналкани в сильнополярних середовищах здатні до іонізації. Вона проходить тим легше, чим більш стабільні іони, що утворюються. Стійкість алкільних карбкатіонів зумовлена де-локалізацією позитивного заряду за рахунок + І -ефекту алкільних груп і зростає в ряді метил − етил − ізопроприл − ізобутил.
Тому утворення третинного карбкатіона для молекули енергетично вигідніше, ніж вторинного та тим більше − первинного. Через це третинні галогеналкани легко піддаються іонізації та найбільш реакційноздатні у реакціях, що ідуть за механізмом SN 1.
Вплив розчинника на перебіг реакцій за механізмом SN 1 зумовлений ефектом сольватації. Протонні полярні розчинники, такі, як вода, спирти, мурашина кислота, оцтова кислота, сприяють іонізації галогеналкану та добре сольватують карбкатіони і аніони, що утворюються, підвищуючи їх стійкість. Ці розчинники прискорюють реакції, які ідуть за механізмом SN 1.
Таким чином, первинні галогеналкани звичайно реагують за механізмом SN 2, третинні − за механізмом SN 1. Вторинні галогеналкани в залежності від природи нуклеофілу та розчинника можуть реагувати як за механізмом SN 1 та SN 2. Сильні нуклеофільні реагенти і апротонні полярні розчинники (нітробензол, диметилформамід, ацетонітрил та ін.) сприяють проходженню реакції за механізмом SN 2, а протонні полярні розчинники (вода, метиловий спирт, етиловий спирт, мурашина кислота, оцтова кислота та ін.), котрі мають високу сольватуючу здатність, сприяють взаємодії за механізмом SN 2.
Галогеналкани вступають у численні реакції нуклеофільного заміщення. Важливе синтетичне значення мають наступні реакції.
1. Гідроліз галогеналканів. При гідролізі галогеналкани утворюють спирти. Реакція з водою проходить повільно і є оборотною:
С2Н5Вг + НОН «С6Н5ОН + НВг
брометан етанол
Тому звичайно гідроліз проводять у присутності водних розчинів лугів або карбонатів лужних металів:
С2Н5Вг + NaОН «С6Н5Na + НВг.
2. Взаємодія з алкоголятами та фенолятами
При дії на галогеналкани алкоголятів і фенолятів утворюються етери (прості ефіри). Третинні галогеналкани утворюють як побічні продукти алкени.
С2Н5Вг + NaOC2H5 ® С2Н5−О−С2Н5
етилат натрію діетиловий ефір
Реакцію було відкрито у 1851 р. англійським хіміком А. У. Вільямсоном, і до цього часу вона використовується як один з кращих методів одержання простих ефірів.
3. Взаємодія з солями карбонових кислот
При дії на галогеналкани солей карбонових кислот у середовищі апротонного полярного розчинника (димєтилформамід, диметилсульфоксид) утворюються складні ефіри. Реакція проходить за механізмом SN 2.
С2Н5Вг + CH3COONa ® + CH3COOС2Н5 + NaВг
ацетат натрію етилацетат
4. Взаємодія з аміаком, алкіл- і ариламінами
При взаємодії галогеналканів з надлишком аміаку утворюється суміш первинних, вторинних і третинних амінів, а також солі четвертинних амонієвих основ. Наприклад:
С2Н5Вг + NH3 ® С2Н5NH2 + HВг.
етиламін
Аналогічно реагують галогеналкани з алкіл- і ариламінами.
5. Взаємодія з солями ціановодневої кислоти
Оскільки ціанід-іон є амбідентним нуклеофілом (має два нуклеофільні центри), при взаємодії галогеналканів з солями ціановодневої кислоти, у залежності від умов проведення реакції, утворюються нітрили або ізоціаніди (ізонітрили):
Первинні та вторинні галогеналкани з солями лужних металів ціановодневої кислоти (КCN, NaСN) в середовищі апротонного полярного розчинника (диметилформамід, ацетон) з високими виходами утворюють нітрили (механізм SN 2):
С2Н5Вг + NаСºN ® С2Н5−СºN + NaВг
пропанонітрил
Основними продуктами реакції вторинних і третинних галогеналканів з ціанідом срібла в середовищі протонного полярного розчинника є ізоціаніди (ізонітрили). Реакція відбувається за механізмом SN 1.
(СН3)2СНBr + AgCN ® (СН3)2СН −NºC + AgBr.
ізопропілізоціанід
6. Взаємодія з солями нітритної кислоти
Взаємодія галогеналканів з солями азотистої кислоти, що містять амбідентний нітрит-іон, проходить у залежності від умов проведення реакції з утворенням нітросполук або ефірів нітритної кислоти.
Первинні та вторинні галогеналкани з нітритом натрію за умов реакції SN 2 утворюють переважно нітросполуки:
С2Н5−Вг + NaNO2 ® С2Н5 −NO2 + NaВг.
нітроетан
Вторинні та третинні галогеналкани з АgNО2 за умов реакції утворюють ефіри нітритної кислоти:
С2Н5 −Вг + AgNO2 ® С2Н5 −O−N=O + AgВг.
ізопропілнітрит
Взаємодія з солями галогеноводневих кислот (реакція Фінкельштейна). За допомогою цієї реакції в молекулі галогеналкану можна замінити один галоген на інший. Взаємодія галогеналканів з солями галогеноводневих кислот є оборотним процесом. Для зміщення рівноваги праворуч використовують різну розчинність вихідних речовин і продуктів реакції. Реакція має практичне значення для одержання первинних фтор- і йодалканів з більш доступних хлор- і бромпохідних. Для добування йодидів реакцію проводять в ацетоні, тому що йодид натрію розчинний в ацетоні, а NaCl або NaВг, які утворюються у процесі взаємодії, випадають в осад:
С2Н5 −Вг + NaI ® С2Н5 −I + NaВг.
Б. Реакції елімінування (Е)
 Кожний реагент, що містить атом з неподіленою парою електронів або з негативним зарядом, поряд з нуклеофільними властивостями виявляє також основні властивості. Отже, він здатний не тільки надавати пару електронів для утворення зв’язку з електрофільним атомом вуглецю, але і відщеплювати від молекули, яка має рухливі атоми водню, протон. У молекулі галогеналкану внаслідок − І -ефекту атома галогену атоми водню b-карбонового атома набувають рухливості:
Кожний реагент, що містить атом з неподіленою парою електронів або з негативним зарядом, поряд з нуклеофільними властивостями виявляє також основні властивості. Отже, він здатний не тільки надавати пару електронів для утворення зв’язку з електрофільним атомом вуглецю, але і відщеплювати від молекули, яка має рухливі атоми водню, протон. У молекулі галогеналкану внаслідок − І -ефекту атома галогену атоми водню b-карбонового атома набувають рухливості:
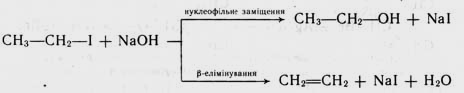 Тому в більшості випадків паралельно з реакцією нуклеофіль-ного заміщення атома галогену проходить реакція відщеплення галогеноводню (р-елімінування) з утворенням алкену, наприклад:
Тому в більшості випадків паралельно з реакцією нуклеофіль-ного заміщення атома галогену проходить реакція відщеплення галогеноводню (р-елімінування) з утворенням алкену, наприклад:
Реакції нуклеофільного заміщення та елімінування конкурують одні з одними і за певних умов кожна з них може стати домінуючою. Відщеплення галогеноводню від галогеналкану стзє головним процесом у присутності нуклеофільних реагентів, що виявляють високу основність. До них відносяться спиртові розчини гідроксидів лужних металів (наприклад, спиртовий розчин NаОН, KОH або алкоголяти лужних металів (наприклад, С2Н5ONa). Елімінуванню сприяє також підвищення температури реакційної суміші та концентрації реагентів. Сприятливий впливv має збільшення числа замісників при електрофільному атомі Карбону. Тому особливо легко елімінування проходить у третинних галогеналканів. Якщо в молекулі галогеналкану е альтернативні шляхи відщеплення галогеноводню, то реалізується з них переважно той, при якому подвійний зв’язок утворюється при найбільш заміщеному атомі вуглецю. Тобто разом з галогеном відходить водень від найменш гідрогенізованого сусіднього атома Карбону (правило Зайцева):
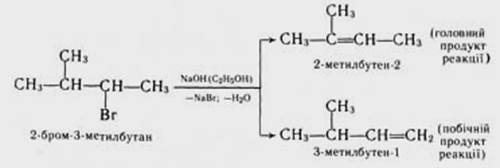
Аналогічно нуклеофільному заміщенню, елімінування галогеналканів може проходити за бімолекулярним механізмом (Е 2) та мономолекулярним механізмом (Е 1).
Механізм Е 2 (бімолекулярне елімінування) схожий з механізмом бімолекулярного нуклеофільного заміщення та може бути поданий такою схемою:
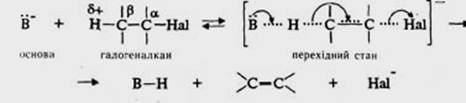
Швидкість реакції залежить від концентрації обох реагентів і описується кінетичним рівнянням другого порядку. Процеси розриву і утворення зв’язків у перехідному стзні відбуваються синхронно.
Різниця між механізмзми SN 2 і E 2 полягає в тому, що в механізмі SN 2 частинка з неподіленою парою електронів або частинка, яка несе негативний заряд, атакує електрофільний атом вуглецю молекули галогєналкану, діючи при цьому як нуклеофіл, а в механізмі Е 2 вона атакує атом водню при b-карбоновому атомі, діючи як основа. Тому процеси SN 2 і E 2 є конкуруючими. Найлегше за механізмом Е 2 відбувається елімінування в первинних галогеналканів.
Механізм Е 1 (мономолекулярне елімінування) схожий з механізмом SN 1 і є двостадійним процесом. На стадії І, під впливом розчинника відбувається іонізація молекули галогеналкану з утворенням карбкатіона. Процес іонізації іде повільно та визначає швидкість реакції в цілому. На другій стадії карбкатіон, що утворився, стабілізується, відщеплюючи протон від b-карбонового атома з утворенням алкену.
Акцептором протона часто виявляється сам розчинник, наприклад вода, тому реакція, яка проходить за механізмом Е 1, звичайно не вимагає присутності основи як реагенту. В реакції елімінування за механізмом Е 1 найлегше вступають третинні галогеналкани.
В. Взаємодія з металами
Галогеналкани реагують з деякими металами, утворюючи металоорганічні сполуки. Найчастіше як метал використовують магній. При взаємодії галогеналканів з металічним магнієм у середовищі безводного діетилового ефіру утворюються магнійорганічні сполуки, відомі під назвою реактивів Гріньяра:
С2Н5С1 + Mg ® С2Н5 − Mg − С1
етилмагнійхлорид
Реактиви Гріньяра є надто реакційноздатними речовинами. їх активність зумовлена полярністю зв’язку С − Mg. Оскільки атом вуглецю має більшу електронегативність, ніж магній, зв’язок С − Mg поляризований таким чином, що на атомі карбону з’являється частковий негативний заряд, внаслідок цього магнійорганічні сполуки е сильними нуклеофільними реагентами і сильними основами.
При взаємодії галогеналканів з металічним натрієм металоорганічні сполуки утворюються як проміжні продукти.
Г. Відновлення галогеналканів
При відновленні галогеналканів утворюються алкани. Відновником найчастіше є водень у присутності каталізаторів гідрування (Pt, Pd):
С2Н5С1 ® С2Н6 + НС1.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 4822; Нарушение авторских прав?; Мы поможем в написании вашей работы!