
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
І. Алкени
|
|
|
|
| Визначення | Функціо- нальні групи | Загальна формула | Номенк- латурна назва | Будова | Застосування | Добування | Фізичні і Хімічні властивості |
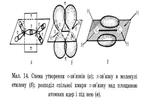
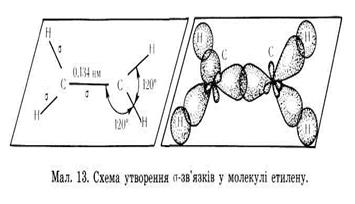
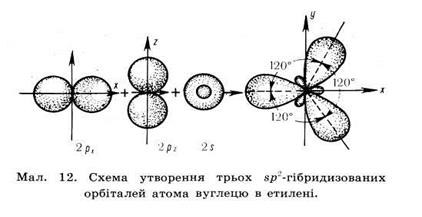
| Ненасичені вуглеводні – вуглеводні в молекулах яких атоми карбону зв’язані між собою кратними (подвійними чи потрійними зв’язками) Алкени– це ненасичені вуглеводні з одним подвійним зв’язком. Полімери – речовини молекули яких (макромолекули) складаються з великої кількості груп атомів (структурних ланок) зв’язаних між собою хімічними зв’язками. | С = С | CnH2n | Нумерація починається з того краю де ближче знаходиться подвійний зв'язок,після кореня пишеться номер карбону з якого починається подвійний зв'язок,в кінці пишеться закінчення ен | Два атоми Карбону, що приймають участь в утворенні подвійного зв’язку знаходяться в стані sр2– гібридизації. Тобто із чотирьох існуючих орбіталей кожного атома вирівнюють ся лише три (одна s, та дві р орбіталі), і одна р – орбіталь лишається не гібридизована (має форму гантелі). Три гібридизовані орбіталі кожного атома карбону розташовуються у вигляді двох рівносторонніх трикутників на площині.
Однією вершиною ці трикутники перекриваються утворюючи δ-зв'язок інші орбіта лі утворюють δ- зв’язки з атомами гідрогенів
 Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно площині δ-звязків, перекриваються над і під площиною, утворюючи π – зв'язок. Отже подвійний зв'язок алкенів містить один δ-зв'язок і один π-зв'язок. δ-зв'язок міцніший ніж π-зв'язок.
Не гібридизовані р-орбіталі обох атомів карбонів розташовуються перпендикулярно площині δ-звязків, перекриваються над і під площиною, утворюючи π – зв'язок. Отже подвійний зв'язок алкенів містить один δ-зв'язок і один π-зв'язок. δ-зв'язок міцніший ніж π-зв'язок.
| 1.етилен використовують для органічного синтезу поліетилену, етанолу, хлор етану, вінілхлориду, стиролу. 2.етилен прискорює дозрівання фруктів. | 1. відщеплення галогенів від галогенопохідних алканів СН3-CHBr-CH2Br +Zn→CH3-CH=CH2+ ZnBr2 2.Відщеплення галоген оводнів за правилом Зайцева:атом Гідрогену від’єднується від менш гідрогенізованого атома Карбону CH3-CHCl-CH3+ NaOH →CH2=CH-CH3+ NaCl +H2O 3.відщеплення води (дегідратація) CH3-CHOH-CH2-CH3 → CH2=CH-CH2-CH3 +H2O 4.відщеплення водню від алканів (дегідрогенування) CH3-CH2-CH2-CH3 → CH3-CH=CH-CH3 +H2 5. крекінг алканів C8H18 →C4H10+C4H8 6. часткова гідрогенізація алкінів. CHΞCH+H2→CH2=CH2 | C2Н4– С5Н10 -гази, С6Н12 – С14Н28 –рідини, С15Н30 і вище –тверді речовини. Вони практично не розчинні у воді і частково розчинні у спиртах. 1. Реакція приєднання – характерна для всіх ненасичених вуглеводнів А) приєднання водню C2H4+H2→C2H6 Б) приєднання галогенів C2H4+Cl2 →C2H4Cl2 В) приєднання води C2H4+H2O →C2H5OH Г) приєднання галогеноводнів правило Марковнікова: Гідроген приєднується до більш гідрогенізованого атома карбону CH3-CH=CH2 +HCl →CH3-CHCl-CH3 2.окиснення: А) повне окиснення (горіння) C2H4+3O2→2 CO2 +2H2O Б) часткове окиснення – знебарвлення розчину марганцівки – якісна реакція на ненасичені вуглеводні. 3C2H4+2KMnO4+4H2O → 2MnO2+ 3CH2OH-CH2OH +2KOH 3. полімеризація – послідовне сполучення однакових молекул у більші за розміром (полімери) CH2=CH2+ CH2=CH2 +CH2=CH2→ -CH2-CH2-CH2-CH2-CH2-CH2- → (-CH2-CH2-)n ,n – ступінь полімеризації |
| Гомологічний ряд | |||||||
| С2Н4 – етен (етилен) С3Н6 – пропен С4Н8 – бутен С5Н10 – пентен С6Н12 – гексен С7Н14 – гептен С8Н16 – октен С9Н18 – нонен С10Н20 - декен | |||||||
| Види ізомерії | |||||||
| 1.ізомерія карбонового ланцюга 2.ізомерія положення подвійного зв’язку 3. просторова ізомерія 4.міжкласова ізомерія з циклоалканами. |
Будова молекули етилену

Приклади назв алкенів по міжнародній номенклатурі
 СН3
СН3



 С6Н3 – С5 – С4Н2 – С3Н = С2Н– С1Н3 С1Н2 = С2Н – С3Н2 – С4Н2 – С5Н – СН3
С6Н3 – С5 – С4Н2 – С3Н = С2Н– С1Н3 С1Н2 = С2Н – С3Н2 – С4Н2 – С5Н – СН3
СН3 С6Н2 – С7Н3
5,5 –диметилгекс-2-ен 5-метилгепт-1-ен.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 686; Нарушение авторских прав?; Мы поможем в написании вашей работы!