
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Педагогіка як наука
|
|
|
|
S
V
V T T
VT1T2TT1T2T
№6
Закон Гей-Люсака

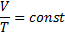








 P P V
P P V



 P2 P2 P2<P1
P2 P2 P2<P1
 P1 P1 P1
P1 P1 P1
№7
Закон Дальтона
Тиск у газовій суміші дорівнює сумі парціальних тисків усіх газів у суміші.

№8
Закон Авогадро. Універсальна газова стала
При однакових тисках та температурах, об’єм 1 моля газу однаковий. 
Універсальна газова стала: 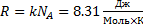
№9
Дати визначення середньої квадратичної та середньої швидкості молекул газу. Яка більша?



№10
Розподіл Максвелла. Найбільш імовірна швидкість молекул?
Якщо в системі знаходиться m частинок, то відносна кількість молекул, що матимемо в інтервалі швидкостей 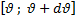

 - найбільш імовірна швидкість
- найбільш імовірна швидкість
№11
Розподіл Больцмана. Барометрична формула
Розподіл молекул газу з висотою. Встановлюється завдяки дії сили тяжіння і теплового руху молекул.
№12
Внутрішня енергія термодинамічних систем
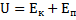
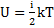 (внутрішня енергія 1 частинки)
(внутрішня енергія 1 частинки)
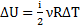 (зміна внутрішньої енергії)
(зміна внутрішньої енергії)
№13
Кількість теплоти. Зміна агрегатних станів речовини шляхом теплопередачі
Кількість теплоти – енергія, яка надається системі
 – кількість теплоти при нагріванні
– кількість теплоти при нагріванні
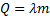 – кількість теплоти при плавленні/кристалізації
– кількість теплоти при плавленні/кристалізації
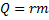 – кількість теплоти при пароутворенні/конденсації
– кількість теплоти при пароутворенні/конденсації
№14
Що означає, що dU є повним диференціалом? Яка основна властивість повного диференціалу
Внутрішня енергія – функція стану системи, не залежить від способу переходу з однієї точки системи в іншу, тому є повним диференціалом.
№15
Що означає твердження, що δQ та δA – варіації? Чим варіації відрізняються від повного диференціалу.
δQ та δA – варіації, бо при переході з однієї точки системи в іншу їх приріст може набувати різного значення, в залежності від способу переходу.
№16
Робота в термодинаміці. Вираз для δA при довільному процесі
Робота, яка виконується при переведенні термодинамічної системи зі стану 1 в стан 2. Дорівнює площі під графіком процесу.
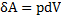

№17
Робота при ізобарному та ізохорному процесах
1) 
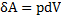
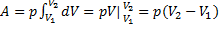

2) 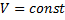
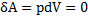
№18
Робота при ізотермічному процесі

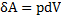
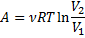
№19
Робота при адіабатичному процесі

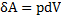

№20
1 закон термодинаміки та його застосування до різних ізопроцесів у газах
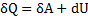
| Процес | Рівняння | dU | 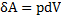
| 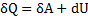
| 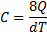
| 
|
| Ізохорний | 
| 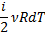
| 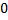
| 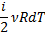
| 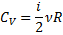
| 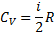
|
| Ізобарний | 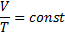
| 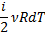
| 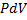

| 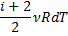
| 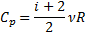
| 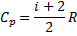
|
| Ізотермічний | 
| 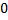
| 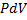
| 
| 
| 
|
| Адіабатичний | 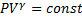
| 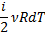
| 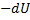
| 
| 
| 
|
№21
Повна, питома та молярна теплоємності
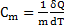 - питома теплоємність
- питома теплоємність
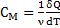 – молярна теплоємність
– молярна теплоємність
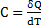 - повна теплоємність
- повна теплоємність
№22
Одержати вирази для молярних теплоємкостей Cp; Cν; CT; Ca з 1 закону термодинаміки

 R
R

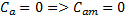
№23
Що таке ступінь вільності?
Ступінь вільності – найменше число координат, що визначає положення даної частинки в просторі
№24
Записати вирази для dU через кількість ступенів вільності та через Cν для 1 моля і для довільної кількості газу
| Процес | dU | dU(Cν) | dU(Cν 1моль) |
| Ізохорний V=const | 
| 
| 
|
| Ізобарний P=const | 
| 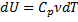
| 
|
| Ізотермічний T=const | 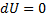
| 
| 
|
| Адіабатичний Q=const | 
| 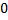
| 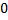
|
№25
Дати визначення адіабатичного процесу, рівняння адіабати.
Адіабатичний процес – це зміна стану тіла без обміну теплом з навколишнім середовищем.
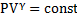 - рівняння процесу
- рівняння процесу
№26
Формула Майєра
Cp=CV+R
№27
Чому дорівнює показник адіабати. Записати вираз для показника адіабати через кількість ступенів вільності?

№28
Дати визначення політропного процесу. Яким ізопроцесам відповідають записані показники політропи n=0;1;γ;∞
Політропний процес – це процес в ідеальному з довільною сталою в часі теплоємністю
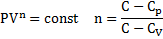
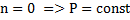 - ізобарний
- ізобарний
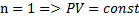 – ізотермічний
– ізотермічний
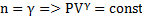 – адіабатичний
– адіабатичний
 - ізохорний
- ізохорний
№29
Теплоємність при політропному процесі

№30
Записати вираз для теплоємності CV через кількість ступенів вільності

№31
Записати вираз для Cp через кількість ступенів вільності
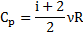
№32
Коловий процес. Оборотний та необоротний процес
Коловий процес – замкнутий цикл(прямий або зворотній).
Оборотний процес – термодинамічний процес, який здійснюється системою спочатку в прямому, а потім в зворотному напрямі, з поверненням системи в початковий стан, без змін в середовищі.
Необоротні процеси – всі інші.
№33
Чому графічно дорівнює робота при коловому процесі



 Прямий цикл Зворотній цикл
Прямий цикл Зворотній цикл



 P P
P P

 A>0 A<0
A>0 A<0
V1 V2 V V1 V2 V

№34
Цикл Карно в координатах P-V





 P 1 ізотерма
P 1 ізотерма
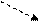
 2
2
 4 3 адіабата
4 3 адіабата
№35
Цикл Карно в координатах T-S. ККД циклу Карно



 T 1(адіабата) 2
T 1(адіабата) 2
 4 (адіабата) 3
4 (адіабата) 3
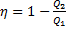 , де Q2 – теплота корисна (Або робота); Q1 – теплота затрачена
, де Q2 – теплота корисна (Або робота); Q1 – теплота затрачена
 , де T2 – температура зовнішнього середовища; T1 – температура нагрівача
, де T2 – температура зовнішнього середовища; T1 – температура нагрівача
№36
Другий закон термодинаміки
Другий закон термодинаміки – неможливо самовільно передати енергію від менш нагрітого тіла до більш нагрітого.
№37



 Принцип роботи теплових машин та холодильника
Принцип роботи теплових машин та холодильника

 Нагрівач Нагрівач
Нагрівач Нагрівач

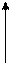
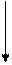 Робоче тіло
Робоче тіло 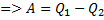 Робоче тіло
Робоче тіло 

Холодильник Холодильник
№38
Дати визначення ентропії. Другий закон термодинаміки записаний через ентропію.
Ентропія (S) – міра енергії, яка не може бути використана для виконання роботи. Вона також є мірою безладдя, присутньої в системі
№39
Зміна ентропії для різних ізопроцесів у газах
Ізохора: 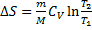
Ізотерма: 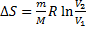
Адіабата: 

№40
Нерівність Клаузіса. Об’єднання Першого та Другого законів термодинаміки.
Нерівність Клаузіса – ККД частково, або повністю необоротного циклічного процесу, завжди менша, ніж ККД оборотного циклу. Наслідок з теореми Карно.
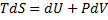 – об’єднання першого та другого законів термодинаміки
– об’єднання першого та другого законів термодинаміки
№41
Третій закон термодинаміки
По мірі наближення температури до значення 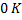 , ентропія деякої рівноважної системи при ізотермічних процесах перестає залежати від будь-яких термодинамічних параметрів.
, ентропія деякої рівноважної системи при ізотермічних процесах перестає залежати від будь-яких термодинамічних параметрів.
В граничному випадку  ентропія приймає одне й те саме, для всіх систем, значення, яке можна приймати за
ентропія приймає одне й те саме, для всіх систем, значення, яке можна приймати за 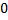
№42
Термодинамічні потенціали
Це набір функцій стану термодинамічної системи, який характеризує її поведінку при термодинамічних процесах.
1) U – внутрішня енергія
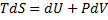
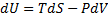
2) F – вільна енергія
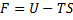
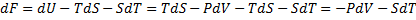
3) H – ентальпія
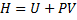

4) G – гіпсотермодинамічний потенціал
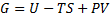
№43
Явища переносу в газах. Стаціонарні рівняння переносу
Явища переносу – це незворотні процеси в термодинамічних системах, при яких відбувається перенос енергії(теплопровідність), маси(дифузія), імпульсу(в’язкість).
| Теплопровідність | В’язкість | Дифузія | |
| Рівняння переносу | 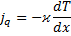 Рівняння Фур’є
Рівняння Фур’є
|  Рівняння Ньютона
Рівняння Ньютона
| 
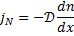 Рівняння Фіка
Рівняння Фіка
|
№44
Зв'язок між коефіцієнтами переносу
Коефіцієнт теплопровідності 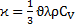
Коефіцієнт в’язкості 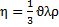
Коефіцієнт дифузії 
Коефіцієнт теплопровідності зв’язується з коефіцієнтом дифузії за допомогою коефіцієнта температуропровідності 
Коефіцієнт в’язкості зв’язується з коефіцієнтом дифузії за допомогою коефіцієнта кінематичної в’язкості 
№45
Перелічити умови, за якими газ можна вважити ідеальним
1) Розмірами та формою частинок можна знехтувати
2) Силами взаємодії між частинками можна знехтувати
№46
Рівняння Ван-дер-Вальса. Які властивості реальних газів враховані в моделі Ван-дер-Вальса?

Фактично рівняння Ван дер Ваальса описує різницю між станом реального та ідеального газів. Також це рівняння враховує взаємодію молекул газів між собою, протягування яких зумовлене Ван-дер-Ваальсовими силами, а відштовхування принципом Паулі
№47
Ізотерми реального газу. Ізотерми Ван-дер-Вальса. Правило Максвелла.
Для дослідження поведінки реального газу розглянемо ізотерми Ван-дер-Ваальса для одного моля, які визначаються рівнянням:
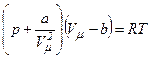 .
.
Перетворимо це рівняння до вигляду:

і
 .
.
Отримане рівняння є алгебраїчним рівнянням третього ступеня відносно молярного об’єму. Коефіцієнти рівняння залежать від тиску, температури і хімічної природи газу. Залежно від числових значень p і T для даного газу це рівняння може мати або три дійсні корені або один дійсний і два уявні, причому фізичний зміст мають лише дійсні додатні корені. Ізотерми газу, які описуються рівнянням Ван-дер-Ваальса, мають вигляд, наведений на рис. 91, де 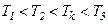 .
.
 При температурах
При температурах  є область станів, де кожному значенню тиску відповідають три точки ізотерми й ізотерма має хвилястоподібну ділянку. При підвищенні температури ці три точки зближуються і при
є область станів, де кожному значенню тиску відповідають три точки ізотерми й ізотерма має хвилястоподібну ділянку. При підвищенні температури ці три точки зближуються і при  зливаються в одну точку
зливаються в одну точку 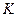 , яка є точкою перегину ізотерми. Дотична до ізотерми в точці
, яка є точкою перегину ізотерми. Дотична до ізотерми в точці 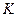 паралельна до осі абсцис. При температурах
паралельна до осі абсцис. При температурах  ізотерми Ван-дер-Ваальса близькі до ізотерми ідеального газу.
ізотерми Ван-дер-Ваальса близькі до ізотерми ідеального газу.
№48
Критична точка. Критичні температура, тиск та об’єм.
При підвищенні температури серед ізотерм з хвилеподібними ділянками є одна, що не має таких ділянок. Така ізотерма називається критичною, а температура  – критичною. При цій температурі зникає різниця між різними станами речовини і коефіцієнт поверхневого натягу дорівнює нулю. Відповідні
– критичною. При цій температурі зникає різниця між різними станами речовини і коефіцієнт поверхневого натягу дорівнює нулю. Відповідні  об’єм
об’єм 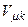 і тиск
і тиск 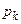 називаються критичними. Стан з критичними параметрами
називаються критичними. Стан з критичними параметрами  називається критичним станом.
називається критичним станом.
Знайдемо критичні параметри. Якщо
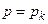 ,
,  і
і  ,
,
то
 .
.
При  всі три корені збігаються і дорівнюють
всі три корені збігаються і дорівнюють 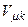 . Отже, рівняння Ван-дер-Ваальса може бути записане у вигляді:
. Отже, рівняння Ван-дер-Ваальса може бути записане у вигляді:
 ,
,
або
 .
.
Отримані вище два вирази рівняння Ван-дер-Ваальса тотожні і в них повинні бути рівні коефіцієнти при однакових степенях. Тому
 ,
,
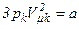 ,
, 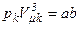 .
.
Поділивши третє рівняння на друге, отримуємо вираз для 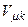 . Якщо підставити отриманий вираз для
. Якщо підставити отриманий вираз для 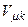 у третє рівняння, маємо вираз для
у третє рівняння, маємо вираз для 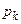 . Тоді з першого рівняння, враховуючи вирази для
. Тоді з першого рівняння, враховуючи вирази для 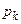 і
і 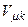 , отримаємо співвідношення для
, отримаємо співвідношення для  . В результаті
. В результаті
 ,
,  ,
, 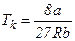 .
.
Отже, критичні величини  ,
, 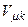 ,
, 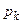 безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
№49
Записати вирази для критичних параметрів
 ,
,  ,
, 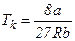 .
.
№50
Фазові переходи. Зобразити лінії фазових переходів в координатах P-T
Якщо через крайні точки горизонтальних ділянок сімейства Ван-дер-Ваальсівських ізотерм провести лінії, то одержуємо криву, що обмежує область двофазних станів речовини
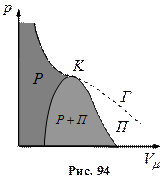 Пара відрізняється від інших газоподібних станів тим, що при ізотермічному стиску відбувається процес зрідження.
Пара відрізняється від інших газоподібних станів тим, що при ізотермічному стиску відбувається процес зрідження.
Газ, який знаходиться в стані при температурі, що вища за критичну, не може бути перетворений в рідину ні при якому тиску.
Педагогіка — наука, що вивчає процеси виховання, навчання і розвитку особистості.
Назва її походить від грецьких слів «paidos» — дитина і «ago» — веду, тобто «дітоводіння». У Давній Греції так називали рабів, які супроводжували дітей рабовласників до школи, пізніше — вільнонайманих людей, котрі займалися наставництвом, вихованням та навчанням дітей. Називали ще їх педономами, дидаскалами, майстрами.
До XVII ст. педагогіка розвивалась у лоні філософії, що була тоді майже всеохоплюючою системою наукових знань. Але розвиток матеріального виробництва і духовної культури, зростання у зв'язку з цим ролі освіти і школи, розширення та ускладнення навчально-виховної діяльності й збагачення відповідного фахового досвіду зумовили виокремлення педагогіки в самостійну науку.
Кожна наука має свої предмет і об'єкт дослідження та є синтезом знань про явища дійсності, які вона вивчає. Разом з тим вона неодмінно перебуває в певних взаємозв'язках з іншими науками.
Предмет педагогіки — особлива сфера суспільної діяльності з виховання людини, складовими частинами якої є освіта і навчання.
Педагогіка досліджує виховання як свідомий і планомірний процес підготовки людини до життя і праці, розкриває його сутність, закономірності, тенденції та перспективи, вивчає принципи і правила, які регулюють виховну діяльність.
Як і кожна наука, педагогіка покликана теоретично узагальнювати факти, проникати у внутрішню природу явищ, виявляти їх причини, передбачати їх розвиток. Вона аналізує об'єктивні закономірності виховного процесу, досліджує істотні й необхідні, загальні та стійкі зв'язки, причинно-наслідкові залежності в ньому. Їх знання дає можливість правильно будувати педагогічний процес, прогнозувати результати виховання і здійснювати його відповідно до потреб суспільства.
Педагогічна наука виникла і розвивалась як теорія виховання підростаючих поколінь. Зумовлено це тим, що людина, її духовні та фізичні якості формуються в дитинстві, підлітковому віці та юності. Саме у ці періоди життя розвиток особистості відбувається найбільш інтенсивно, формуються найголовніші її риси та особливості — розумові та фізичні сили, основи світогляду, переконань, моральних почуттів, риси характеру, спрямованість потреб, інтересів, уподобань тощо. Тому істотні прогалини і недоліки у вихованні, допущені в ранньому віці, ліквідувати пізніше надзвичайно важко, а іноді й неможливо.
Педагогіка вивчає процеси виховання, освіти і навчання лише у властивих їй межах, розглядає у цих процесах тільки педагогічний аспект. Вона досліджує те, на яких загальнопедагогічних засадах, завдяки яким засобам виховної роботи потрібно будувати виховний процес, освіту і навчання людей різних вікових груп в освітніх закладах, в усіх типах установ, організацій і трудових колективів.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 364; Нарушение авторских прав?; Мы поможем в написании вашей работы!