
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фізичні та хімічні властивості кисню
|
|
|
|
Кисень — безбарвний газ, без запаху та смаку, трохи важчий за повітря, температура плавлення дорівнює -218,8 °С, температура кипіння —182,9 °С. Рідкий кисень блакитного кольору, а твердий - утворює кристали синього. В усіх агрегатних станах кисть парамагнітний, Будова молекул описуєтеся лише методом МО. Кисень слабо розчинний у воді: в 100 об'ємах води при 20 °С розчиняється 3 об'єми кисню. Однак навіть така мала його кількість забезпечує життєдіяльність водних організмів.
Кисень виявляє широкий діапазон ступенів окиснення в сполуках. У зв'язку з тим, що атому кисню не вистачає двох електронів до завершення зовнішнього енергетичного рівня, він легко може приймати їх від менш електронегативних елементів, виявляючи мінімальний ступінь окиснення — 2 (Н2О, КОН, H2SO4). У пероксидах кисень має ступінь окиснення — 1 (Н2О2, Na2O2), в над пероксидах — - 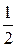 (KO2), а в озонідах — -
(KO2), а в озонідах — - 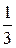 (КО3). Крім негативних, кисень утворює сполуки з фтором із позитивними ступенями окиснення: +1(O2F2), +2(OF2), +4(O3).
(КО3). Крім негативних, кисень утворює сполуки з фтором із позитивними ступенями окиснення: +1(O2F2), +2(OF2), +4(O3).
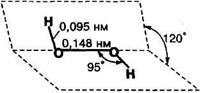
Існує не лише молекулярний кисень О2, а ще й озон О3, його друга алотропна форма. Будову молекули озону можна представити такою схемою:
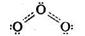
Міжатомна відстань О-О в озоні дорівнює 0,128 нм, це менше ніж довжина одинарного зв'язку (0,149 нм), але більше, ніж довжина подвійного зв'язку в молекулі О2 (0,12 нм), отже, кратність зв'язку в молекулі 1,5.
Озон одержують в приладах-озонаторах, які перетворюють О2 на О3 під дією тихого електричного розряду, створюваного високовольтним трансформатором. За допомогою озонатора лише 10 % кисню перетворюється на озон:
3О2«2О3
У природі озон утворюється з кисню повітря під час грози, а також у розрідженій атмосфері на висоті 20-30 кілометрів під дією ультрафіолетових променів. Озоновий шар має неоціненне значення для розвитку життя на Землі: поглинаючи ультрафіолетові промені, він захищає все живе від згубної дії зовнішнього гамма-випромінювання, а також поглинає інфрачервоні промені, що йдуть від Землі, таким чином перешкоджаючи ЇЇ охолодженню. При повільному окисненні смоли хвойних дерев також утворюється озон. Тому в хвойних лісах відчувається такий самий запах, як у повітрі під час грози, коли теж утворюється деяка кількість озону.
Озон — важкий газ синього кольору (температура плавлення — -193 °С, температура кипіння — -110 оС), з різким запахом, отруйний. О3 — один з дуже сильних окисників, окиснює золото й платину. При дії на метали утворює пероксидні сполуки. Навіть така стійка до окиснення речовина, як срібло, під дією озону перетворюється на пероксид срібла:
2Ag + 3О3 = Ag2О2 + 2О2.
Якісною реакцією на озон є реакція з йодидом калію, в результаті якої виділяється молекулярний йод. При дії озону на вологий йодкрохмальний папір той набуває синього кольору:
2КІ + О3 + Н2О «І2 + 2КОН + О2.
Озон використовують для знезараження питної води. На відміну від обробленої хлором води, яка містить шкідливі неорганічні та органічні сполуки, озонована вода абсолютно нешкідлива для використання в народному господарстві та побуті.
За хімічною активністю кисень поступається лише галогенам. Він утворює сполуки з усіма елементами за винятком легких інертних газів Не, Ne, Аг. За звичайних умов кисень не є сильним окисником. Інакше ми б не змогли спостерігати за розмаїтістю квітів та кольорів, які нас оточують. Лише при підвищеній температурі зв'язок у молекулі О2 руйнується (D 494 кДж/моль) і тоді кисень починає реагувати з усіма простими речовинами, за виключенням галогенів, інертних газів та благородних металів Ag, Au, Pt, Rh. У залежності від умов перебігу реакції кисень утворює чотири типи сполук: оксиди, до складу яких кисень входить у ступені окиснення — 2 (але іони О2- не існують навіть у сполуках Na2O, K3O); пероксиди, які містять пероксидну групу —О—О—; надпероксиди, в структурі яких міститься над пероксид-іон О2-, та озоніди, то містять озонід-іон О3-.
Приєднання молекулою кисню одного електрона дає радикал О2-; речовини, до складу яких входить такий радикал, називаються надпероксидами. Відомі надпероксиди найбільш активних лужних металів (К, Pb, Cs). Одержують їх взаємодією простих речовин:
К + О2°= КО2
Надпероксиди дуже сильні окисники, активно окиснюють воду з виділенням кисню:
4КО2 + 2Н2О = 4КОН + ЗО2.
При взаємодії лужних металів з озоном утворюються озоніди:
К + О3 = КО3.
Озоніди — сполуки, до складу молекул яких входять катіони металів та озонід-іони О3-Г Наявність в озонід-іоні неспареного електрона надає йому властивості радикала та обумовлює забарвлення і парамагнітні властивості.
Приєднуючи два електрони, молекула кисню перетворюється на пероксид-іон О22-, в якому атоми кисню зв'язані одним двох-електронним зв'язком. Похідні О22- називають пероксидами. Найбільше значення в хіміко-фармацевтичній практиці має пероксид водню Н2О2. Він був вперше одержаний французьким хіміком Луї Жаком Тенаром у 1818 році дією сірчаної кислоти на пероксид барію:
ВаО2 + H2SO4 = BaSO4 + Н2О2.
Існує два промислових методи одержання пероксиду водню. Перший — аутоокиснення дигідроксоантрахінонів:
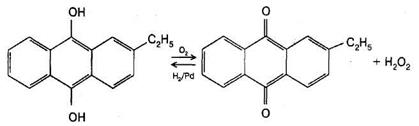
Одержаний хінон відновлюється воднем до антрахінону, який повторно використовується. За цією методикою одержують розчин Н2О2 з масовою часткою 20 %. За другим методом пероксид водню одержують електрохімічним окисненням сірчаної кислоти або сульфату амонію на платиновому аноді при температурі +5—8 °С з утворенням пероксодисірчаної кислоти:
2HSO4- - 2е ® H2S2O8.
Остання гідролізується у водному розчині при температурі = +70 °С, утворюючи Н2О2 та H2SO4:
H2S2O8 + Н2О =- H2SO5 + H2SO4.
H2SO5 + Н2О = H2SO4 + H2O2
Енергія зв'язку О—О (210 кДж/моль) значно менша, ніж у молекулі кисню (494 кДж/моль). Між молекулами Н2О2 існує міцний міжмолекулярний водневий зв'язок. У зв'язку з цим пероксид водню за нормальних умов — сиропоподібна в'язка рідина (р = 1,44 г/см3), з високою температурою кипіння 150,2 °С. З водою змішується у будь-яких співвідношеннях завдяки утворенню нових водневих зв'язків. —- У лабораторній практиці та в медицині використовують розчини Н2О2 з масовою часткою 30 % (пергідроль) або 3 %. Пероксид водню — нестійка сполука, повільно розкладається під дією світла:
2Н2О2 ® 2Н2О + О2.
Реакцію розкладу каталізують МnО2 та катіони важких металів (Cu2+, Fe3+, Mn2+). З цієї причини до розчинів Н2О2, які виготовляються промисловістю, додають стабілізатори.
Водний розчин пероксиду водню — слабка кислота:
2Н2О2 «Н3О+ + НО2-, Кд=1,4 • 10-12
Кислотні властивості Н2О2 можна виявити, додаючи до гексагідроксоалюмінаіу(ІІІ) натрію пероксид водню. При цьому в розчині зростає концентрація катіонів водню, внаслідок чого, у відповідності з принципом Ле-Шательє, спряжена рівновага реакції дисоціації
[А1(ОН2)6]3+«А1(ОН)3 «[А1(ОН)6]3-
змішується ліворуч, а гексагідроксокомплекс руйнується і випадає осад А1(ОН)3. У разі використання замість Н2О2 більш сильної кислоти, рівновага зміщується у бік утворення гексааквакомплексу і осад А1(ОН)3 не утворюється.
Пероксид водню — сильний окисник як у кислому, так і в лужному середовищі. У кислому середовищі він відновлюється до Н2О, а в лужному — до ОН-, наприклад:
2КІ + Н2О2 + H2SO4 = І2 + K2SO4 + 2Н2О.
2К3[Сг(ОН)6] + ЗН2О2 = 2К2СгО4 + 2КОН + 8Н2О.
Під дією досить сильних окисників Н2О2 виявляє відновні властивості, а продуктом його окиснення є вільний кисень:
5Н2О2 + 2КМnО4 + 3H2SO4 = 5О2 + 2MnSO4 + K2SO4 + 8Н2О.
Наведену реакцію використовують у хімічному аналізі для кількісного визначення Н2О2.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1485; Нарушение авторских прав?; Мы поможем в написании вашей работы!