
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль. 2. Кількісний аналіз 4 страница
|
|
|
|
C. Появи жовтого забарвлення
D. *Зникнення червоного забарвлення
E. Зникнення оранжевого забарвлення
209. При броматометричному титруванні натрій саліцилату одна його молекула реагує з трьома молекулами брому, тому еквівалентна маса натрій саліцилату рівна:
A. М/2
B. *М/6
C. М/3
D. М/4
E. 6М
210. При броматометричному титруванні ізоніазиду одна його молекула реагує з двома молекулами брому, тому еквівалентна маса ізоніазиду рівна:
A. 3М/2
B. 3М
C. М/3
D. *М/4
E. М/6
211. При броматометричному титруванні резорцину одна його молекула реагує з трьома молекулами брому, тому еквівалентна маса тимолу рівна:
A. 3М/2
B. 3М
C. М/3
D. М/4
E. *М/6
212. В основі бромометрії лежить схема реакції:
A. Br2 ® 2BrO4-
B. Br2 ® 2BrO2-
C. Br2 ® 2BrO3-
D. *Br2 ® 2Br-
E. Br2 ® 2BrO
213. При прямому броматометричному титруванні тимолу до досліджуваного розчину тимолу додають надлишок калій броміду, розчин хлоридної кислоти, метиловий оранжевий і титрують стандартним розчином:
A. Калій гіпоброміту
B. Калій йод моно броміду
C. Калій броміту
D. *Калій бромату
E. Калій пербромату
214. При прямому броматометричному титруванні тимолу до досліджуваного розчину тимолу додають надлишок калій броміду, розчин хлоридної кислоти, метиловий оранжевий і титрують стандартним розчином:
A. *KBrO3
B. KBrO2
C. KBr
D. KBrO
E. KBrO4
215. При прямому броматометричному титруванні тимолу одна його молекула реагує з двома молекулами брому, тому еквівалентна маса тимолу рівна:
A. 2М
B. *М/4
C. М/3
D. М/2
E. М
216. Броматометричне титрування - це фармакопейний метод визначення:
A. Фенолів
B. *Відновників і деяких органічних речовин
C. Карбонових кислот
D. Всіх органічних речовин
E. Тільки відновників
217. При броматометричному визначенні оксалатної кислоти, вона окиснюється згідно схеми Н2С2О4 ® 2СО2, тому її еквівалентна маса рівна:
A. М/4
B. М/3
C. 2М
D. *М/2
E. М
218. Інколи броматометричне визначення проводять в присутності солей Меркурію (ІІ). Це роблять, щоб:
A. *Збільшити швидкість реакції і забезпечити протікання реакції до кінця
B. Змістити рівновагу реакції
C. Збільшити тільки константу рівноваги
D. Зменшити швидкість реакції і константу реакції
E. Збільшити швидкість реакції
219. В броматометрії інколи застосовують нагрівання для того, щоб:
A. Забезпечити високу константу рівноваги
B. *Збільшити швидкість реакції
C. Забезпечити глибину протікання реакції
D. Видалити леткі продукти взаємодії
E. Зв’язати продукт відновлення бромат-йонів
220. В броматометрії проводять холостий дослід, тому об’єм титранту, який витрачається на визначувану речовину розраховують:
A. Vд - 2Vхол
B. 2Vхол - Vд
C. Vхол - Vд
D. Vд + Vхол
E. *Vд - Vхол
221. Броматометричне титрування проводять в середовищі:
A. Слабкої основи
B. Сильної основи
C. Слабкої кислоти
D. *Сильної кислоти
E. Аміачному
222. При броматометричному титруванні нітритів вони окиснюються до нітратів NO2- ® NO3-, тому в цьому визначенні еквівалентна маса нітрит-йонів рівна:
A. 2М
B. М/4
C. М/3
D. М
E. *М/2
223. При броматометричному визначенні солей As(ІІI) оксиду він окиснюється до арсен (V) оксиду, тому еквівалентна маса As2O3 при цьому визначені рівна:
A. 3М/2
B. 2М/3
C. М/3
D. М/2
E. *М/4
224. При броматометричному визначенні солей Sn(ІІ) вони окиснюються до Sn(IV), тому еквівалентна маса SnCl2 при цьому визначені рівна:
A. М/4
B. М/3
C. *М/2
D. 2М
E. М
225. Виберіть речовину, яку не можна визначати броматометричним методом:
A. Солі стануму (ІІ)
B. Солі арсену (ІІІ)
C. Солі феруму (ІІ)
D. Нітратна кислота
E. *Калій перманганат
226. Броматометрію застосовують для визначення деяких органічних речовин і відновників, які є:
A. Слабшими, ніж бромат-йони
B. Слабшими, ніж пербромат-йони
C. Сильнішими, ніж бромат-йони
D. *Сильнішими, ніж бромід-йони
E. Слабшими, ніж бромід-йони
227. При броматометричному визначенні солей Sb (III) в кислому середовищі 3 молі йонів Sb(III) реагують з одним молем титранту, тому еквівалентна маса H2[SbCl5] при цьому визначенні буде:
A. 3М/2
B. 2М/3
C. М/3
D. *М/2
E. М/4
228. При фіксації точки еквівалентності в броматометрії з метиловим червоним в кінці титрування зникає червоне забарвлення. Це відбувається тому, що:
A. Бром, який утворився, реагує з продуктом взаємодії
B. Бром, який утворився, реагує з водою
C. *вільний бром, який утворився, реагує з індикатором
D. Утворюється вільний бром
E. Зникає вільний бром
229. При застосуванні метилоранжу, як індикатора в броматометрії, проводять холостий дослід для того, щоб врахувати об’єм титранту, що використовується на взаємодію:
A. *З індикатором
B. З окисниками у воді
C. З водою (гідроліз)
D. З відновниками у воді
E. З домішками
230. Стандартизацію стандартного розчину калій бромату можна провести:
A. Кондуктометричним методом
B. Флуориметричним методом
C. *Йодометричним методом
D. Алкаліметричним методом
E. Ацидиметричним методом
231. До якої групи індикаторів належать метиловий оранжевий і метиловий червоний з точки зору їх застосування в броматометрії?
A. Флуоресцентні
B. Адсорбційні
C. *Специфічні необоротні
D. Металохромні
E. Редокс-індикатори
232. Виберіть клас індикаторів, які можуть застосовуватись при броматометричному титруванні:
A. Комплексоутворюючі
B. Осаджувальні
C. *Редокс-індикатори
D. Металохромні
E. Адсорбційні
233. Виберіть індикатор, який застосовують в броматометрії:
A. *Метиловий оранжевий
B. Мурексид
C. Крохмаль
D. Кальконкарбонова кислота
E. Метиленовий синій
234. Виберіть індикатор, який застосовують в броматометрії:
A. Тропеолін
B. Крохмаль
C. Фенолфталеїн
D. *Метиловий червоний
E. Натрій нітропрусид
235. Як розраховується еквівалентна маса бромат-йону відповідно до наступної схеми відновлення BrO3- 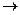 Br-?
Br-?
A. Еm = 2М
B. *Еm = М/6
C. Еm = М/4
D. Еm = М/2
E. Еm = М
236. Виберіть схему, яка відповідає основному рівнянню броматометрії:
A. BrO3- ® Br- + BrO4-
B. BrO3- ® BrO-
C. BrO3- ® BrO4-
D. *BrO3- ® Br-
E. BrO3- ® BrO2-
237. Виберіть метод оксидиметрії:
A. *Броматометрія
B. Меркурометрія
C. Аскорбінометрія
D. Хромометрія
E. Титанометрія
238. При розрахунках еквівалентної маси калій бромату, враховуючи схему його відновлення BrO3- ® Br-, його молярну масу ділять на:
A. *6
B. 5
C. 4
D. 3
E. 2
239. В броматометрії молярна концентрація і молярна концентрація еквівалентів для титранту:
A. Сн = См/2
B. См = 6Сн
C. *Сн = 6См
D. Сн = 2См
E. Рівні
240. Розчин калій бромату може бути.... розчином.
A. Вторинним, який стандартизується за Na2S2O3
B. *Первинним або вторинним стандартним розчином, який стандартизується за Na2S2O3
C. Тільки первинним або вторинним стандартним
D. Тільки вторинним стандартним
E. Тільки первинним стандартним
241. В броматометрії в якості титранту застосовують стандартний розчин:
A. KBrO
B. KBrO2
C. KBrO4
D. KBr
E. *KBrO3
242. Для фіксації точки еквівалентності в хлорйодиметрії застосовують фізико-хімічний метод... або індикатор....
A. Потенціометрії, магнезон
B. Кондуктометрії, дифеніламін
C. Вольтамперометрії, фенолфталеїн
D. *Потенціометрії, крохмаль
E. Флуориметрії, тропеолін
243. Виберіть фізико-хімічний метод для встановлення точки титрування в хлорйодиметрії:
A. Полуменевий емісійний аналіз
B. Кондуктометрія
C. Атомно-абсорбційний аналіз
D. Флуориметрія
E. *Потенціометрія
244. Запропонуйте оксидиметричний метод визначення натрій саліцилату:
A. Меркурометрія
B. Ацидиметрія
C. *Хлорйодиметрія
D. Аскорбінометрія
E. Нітритометрія
245. Хлорйодиметричне титрування проводять в середовищі:
A. Сильно лужному
B. *Кислому, нейтральному і слабко лужному
C. З рН > 3
D. З рН >10
E. З рН < 1
246. Яку речовину можна визначати методом хлорйодиметрії?
A. Йод
B. Калій перхлорат
C. Калій біхромат
D. Калій перманганат
E. *Солі феруму (ІІ)
247. Яку речовину не можна визначати методом хлорйодиметрії?
A. солі феруму (ІІ)
B. аскорбінова кислота
C. *натрій гідроксид
D. фенол
E. резорцин
248. Броматометричним методом можна кількісно визначити вміст
A. кальцій хлориду
B. натрій хлориду
C. пікринової кислоти
D. ацетатної кислоти
E. *саліцилової кислоти
249. Гідрохінон реагує з йод монохлоридом в слабко лужному середовищі у співвідношенні 1:1, тому еквівалентна маса гідрохінону в цьому визначенні становить:
A. 4М
B. М/1
C. *М/2
D. 2М
E. М
250. При хлорйодиметричному визначенні етакридину лактату один моль його реагує з двома молями титранту, тому еквівалентна маса етакридину лактату становить:
A. *М/4
B. 2М
C. М/2
D. М
E. 4М
251. При хлорйодиметричному титруванні резорцину C6H4(OH)2 + 3ICl = C6HI3(OH)2 + 3HCl еквівалентна маса резорцину дорівнює:
A. М/2
B. М
C. 3М
D. *М/6
E. М/3
252. При хлорйодиметричному титруванні фенолу C6H5OH + 3ICl = C6H2I3(OH) + 3HCl еквівалентна маса фенолу дорівнює:
A. 3М
B. *М/6
C. М
D. М/4
E. М/3
253. При зворотньому хлорйодиметричному титруванні надлишок ICl перетворюють в.... і відтитровують стандартним розчином....
A. I2, TiCl3
B. Na2S2O3, I2
C. KI, KIO3
D. *I2, Na2S2O3
E. KIO3, KI
254. При прямому хлорйодиметричному титруванні солей феруму (ІІ) в кінці титрування в присутності крохмалю спостерігають:
A. Випадання чорного осаду
B. Зникнення синього забарвлення
C. *Появу синього забарвлення
D. Зникнення червоно-коричневого забарвлення
E. Появу червоно-коричневого забарвлення
255. Кількісне визначення натрію саліцилату в суміші з натрію гідрокарбонатом проводиться за допомогою методу...
A. титанометрії
B. аскорбінометрії
C. *броматометрії
D. перманганатометрії
E. комплексонометрії
256. При прямому хлорйодиметричному титруванні аскорбінової кислоти як індикатор застосовують 1% розчин крохмалю, тому в к.т.т. спостерігають:
A. зникнення жовто-коричневого забарвлення йоду
B. зникнення синього осаду
C. появу синього осаду
D. *появу синього забарвлення
E. зникнення синього забарвлення
257. При прямому хлорйодиметричному титруванні аскорбінової кислоти як індикатор застосовують:
A. Тропеолін
B. Йод крохмальний папірець
C. *Крохмаль
D. Мурексид
E. Фенолфталеїн
258. Стандартизацію титранту 0,1 моль/л ICl проводять за стандартним розчином:
A. натрій тетраборату
B. *натрій тіосульфату
C. калій перманганату
D. калій йодату
E. калій йодиду
259. При додаванні до визначуваного розчину калій йодиду титранту 0,1 моль/л розчину йод монохлориду утворюватиметься:
A. ICl
B. KСIO3
C. KIO3
D. *I2
E. Cl2
260. Для приготування титранту хлорйодиметрії до суміші KI + KIO3 для протікання реакції утворення ICl додають кислоту:
A. хлоратну
B. хлоритну
C. гіпохлоритну
D. перхлоратну
E. *хлоридну
261. Для приготування титранту хлорйодиметрії до йодидно-йодатної суміші для протікання реакції утворення ICl додають:
A. HClО4 розб
B. HClО конц
C. *HCl конц
D. HClО розб
E. HCl розб
262. Для приготування титранту хлорйодиметрії спочатку отримують речовину ICl шляхом взаємодії:
A. KI + KBrO+ HCl (розб)
B. *KI + KIO3+ HCl (конц)
C. KI + KIO3+ HCl (розб)
D. KI + KIO4+ HCl (конц)
E. KI + KBrO3+ HCl (розб)
263. Аскорбінова кислота титрується йод монохлоридом відповідно до рівняння C6H8O6 + ICl = C6H6O6 + HI + HCl, тому еквівалентна маса аскорбінової кислоти рівна:
A. *М/2
B. 2М
C. М
D. 1/3 М
E. 3/2 М
264. Основне рівняння хлорйодиметрії правильно записане у варіанті:
A. *ICl + 2е = Cl- + I-
B. ICl +1е = Cl- + I-
C. ICl +3е = Cl- + I-
D. ICl -1е = Cl- + I-
E. ICl -2е = Cl- + I-
265. Молярна концентрація еквівалентів стандартного розчину йод монохлориду рівна:
A. *2См
B. См/3
C. См/2
D. 3См
E. См
266. В хлорйодиметрії відновлення титранту відбувається приєднанням.... електронів.
A. 4
B. *2
C. 3
D. 5
E. 1
267. В хлорйодиметрії відбувається відновлення титранту відповідно до схеми:
A. ICl ® Cl- + IO4-
B. ICl ® Cl- + IO3-
C. ICl ® Cl- + IO2-
D. *ICl ® Cl- + I-
E. ICl ® ClO- + I-
268. Завжди вторинним стандартним розчином є розчин:
A. *ICl
B. H2C2O4
C. KBrO3
D. K2Cr2O7
E. NaCl
269. В одному з методів оксидиметрії як титрант застосовують стандартний розчин...., який є.... стандартним розчином:
A. НClО4, вторинним
B. *ICl, вторинним
C. Hg(NO3)2, вторинним
D. NaCl, первинний
E. NaOH, вторинним
270. В одному з методів оксидиметрії як титрант застосовують стандартний розчин:
A. Алюміній фториду
B. Натрій гідроксиду
C. Калій йодиду
D. *Йод монохлориду
E. Хлоридної кислоти
271. В одному з методів оксидиметрії як титрант застосовують стандартний розчин:
A. Hg2(NO3)2
B. Hg(NO3)2
C. *ICl
D. NaOH
E. HCl
272. Йод монохлорид, який застосовується як титрант є:
A. Амфолітом
B. Гідроксидом
C. Відновником
D. Оксидом
E. *Окисником
273. Титрант 0,1 моль/л йод монохлориду застосовується в методі, який називається:
A. Седиметрії
B. Комплексиметрії
C. Редуциметрія
D. *Оксидиметрія
E. Алкаліметрі
274. Йодиметрію у фармацевтичному аналізі використовують для кількісного визначення:
A. *Анальгіну
B. Натрій пероксиду
C. Барій пероксиду
D. Калій перманганату
E. Гідроген пероксиду
275. Йодометрію у фармацевтичному аналізі використовують для кількісного визначення всіх речовин, окрім:
A. Барій пероксиду
B. Натрій пероксиду
C. *Анальгіну
D. Калій перманганату
E. Гідроген пероксиду
276. При йодометричному титруванні перед початком титрування до розчину визначуваної речовини додають.... і титрують стандартним розчином...:
A. Натрій тіосульфат; йодом
B. Йод; натрій тіосульфатом
C. Крохмаль; калій йодидом
D. *Калій йодид; натрій тіосульфатом
E. Крохмаль; йодом
277. Йодометрію у фармацевтичному аналізі використовують для кількісного визначення:
A. Суми бензодіазепінів
B. *Гідроген пероксиду
C. Кофеїну
D. Анальгіну
E. Ізоніазиду
278. Кількісне визначення води в досліджуваному об’єкті проводять йодиметрично по методу:
A. Бутлерова
B. Кучерова
C. Зайцева
D. *Фішера
E. Марковнікова
279. Індикатором йодиметрії є розчин:
A. Мурексид
B. Калій хромату
C. Метилового червоного
D. *Крохмалю
E. Дифеніламіну
280. Методом йодиметрії визначають:
A. Сильні основи
B. Окисники
C. *Відновники
D. Лужні метали
E. Сильні кислоти
281. Йодиметрію у фармацевтичному аналізі використовують для кількісного визначення всіх речовин, окрім:
A. Суми бензодіазепінів
B. Ізоніазиду
C. Кофеїну
D. Анальгіну
E. *Гідроген пероксиду
282. Кількісне визначення води в досліджуваному об’єкті проводять йодиметрично по методу Фішера. Реактив Фішера це:
A. SO2 + I2 + C5H5N в C2H5OH
B. *SO2 + I2 + C5H5N в CH3OH
C. SO2 + I2 + C2H5N в CH3OH
D. I2 + C5H5N в CH3OH
E. SO3 + I2 + C5H5N в C2H5OH
283. Кількісне визначення води в досліджуваному об’єкті проводять йодиметрично по методу Фішера. Реактив Фішера це:
A. *Розчин сульфур діоксиду, йоду і піридину в метанолі
B. Розчин сульфур діоксиду, йоду і піридину в етанолі
C. Розчин йоду і піридину в метанолі
D. Розчин сульфур діоксиду і піридину в метанолі
E. Розчин сульфур триоксиду, йоду і піридину в метанолі
284. При йодиметричному визначенні відновників в присутності крохмалю титрування завершують при:
A. Появі жовтого забарвлення
B. Появі рожево-фіолетового забарвлення
C. *Появі синього забарвлення
D. Зникненні рожево-фіолетового забарвлення
E. Зникненні синього забарвлення
285. При прямому йодиметричному визначенні відновників в присутності хлороформу титрування завершують при:
A. Зникненні жовтого забарвлення водного шару
B. *Появі рожево-фіолетового забарвлення органічного шару
C. Появі синього забарвлення водного шару
D. Зникненні рожево-фіолетового забарвлення органічного шару
E. Зникненні синього забарвлення водного шару
286. В йодиметричному визначенні відновників без індикатора титрування завершують при:
A. *Появі жовтого забарвлення
B. Появі рожево-фіолетового забарвлення
C. Появі синього забарвлення
D. Зникненню рожево-фіолетового забарвлення
E. Зникненню синього забарвлення
287. В йодиметричному визначенні відновників в присутності крохмалю титрування завершують при:
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2747; Нарушение авторских прав?; Мы поможем в написании вашей работы!