
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль. 2. Кількісний аналіз 6 страница
|
|
|
|
A. вторинним стандартним розчином, що стандартизується за натрій карбонатом
B. первинним стандартним розчином
C. первинним, а може бути вторинним стандартним розчином
D. вторинним стандартним розчином
E. *вторинним стандартним розчином, що стандартизується за натрій тіосульфатом
367. Визначення концентрації натрій тіосульфату аналітик здійснює, використовуючи стандартну речовину калій біхромат, а в якості індикатора:
A. метиленовий синій (0,1% розчин).
B. амоній ферум (ІІІ) сульфат (насичений розчин).
C. метиловий оранжевий (0,025 моль/л розчин).
D. метиловий червоний (0,1% розчин).
E. *крохмаль (1% розчин).
368. Реакція йодування органічних речовин за допомогою йод монохлориду протікає недостатньо швидко, тому для визначення, наприклад, етакридину лактату слід провести:
A. пряме або непряме титрування
B. пряме титрування
C. реверсивне титрування
D. непряме титрування
E. *зворотнє титрування
369. Визначення концентрації натрій тіосульфату аналітик здійснює, використовуючи стандартну речовину калій біхромат, а в якості в якості індикатора:
A. Метиленовий синій (0,1% розчин).
B. Амоній ферум (ІІІ) сульфат (насичений розчин).
C. метиловий оранжевий (0,025 моль/л розчин).
D. метиловий червоний (0,1% розчин).
E. *крохмаль (1% розчин).
370. Йодиметрія порівняно з іншими окиснювально-відновними титриметричними методами найчастіше застосовується, тому що:
A. пара І2/2І- має високий окиснювально-відновний потенціал, який не залежить від рН середовища, в якому проводять титрування
B. дозволяє визначення у різних за рН середовищах
C. є єдиним безіндикаторним методом
D. *володіє найвищою точністю
E. володіє найвищою селективністю
371. На величину реального окисно-відновного потенціалу пари найбільший вплив має:
A. природа окисно-відновної пари
B. *конкуруючі реакції
C. іонна сила розчину
D. температура
E. концентрація окисно-відновної пари
372. Найчастіше вміст первинних та вторинних ароматичних амінів в лікарських засобах знаходять по методу:
A. Комплексонометрії
B. Нейтралізації
C. Титанометрії
D. Церіметрії
E. *Нітритометрії
373. Найбільш вагомою перевагою перманганатометрії у порівнянні з біхроматометрією є:
A. є сильнішим окисником, тому реакція проходить більш швидко і кількісно
B. *можливість визначення широкого кола речовин у кислому середовищі, безіндикаторність методу
C. титрант має велику еквівалентну масу, тому вища точність
D. титрант є стійким у часі
E. титрант є первинним стандартним розчином
374. Для чого розраховують і будують криві титрування за методом редоксиметрії
A. Для визначення концентрації іонів
B. Для обчислення рН розчину
C. *Для вибору редокс - індикатора
D. Для обчислення редокс - потенціалу
E. Для встановлення точки еквівалентності
375. Яку реакцію використовують при йодометричному визначенні аскорбінової кислоти в препараті?
A. реакцію окиснення йодид-іонів до йоду
B. реакцію осадження
C. реакцію нейтралізації
D. реакцію окислення бромідів до вільного брому
E. *реакцію відновлення йоду до йодид-іону
376. У якому середовищі найчастіше здійснюють титрування робочим розчином KMnO4?
A. у хлориднокислому
B. у слабко лужному
C. *у сульфатнокислому
D. у спиртовому
E. у нейтральному
377. При визначенні масової частки формальдегіду у формаліні зворотнім йодиметричним титруванням останнім використовують титрант:
A. Розчин крохмалю
B. Розчин натрію нітриту
C. *Розчин натрію тіосульфату
D. Розчин йоду
E. Розчин калію йодиду
378. Титрантом методу нітритометрії є 0,1моль/л розчин натрій нітриту, який готують як вторинний стандартний розчин. Точну концентрацію натрій нітриту встановлюють за:
A. Хлоридною кислотою
B. Сульфатною кислотою
C. *Сульфаніловою кислотою
D. Оксалатною кислотою
E. Калій гідроксидом
379. Які речовини використовують в йодометрії в якості робочих розчинів для прямого і зворотнього титрування відновників?
A. K2Cr2O7, I2
B. *I2, Na2S2O3
C. I2, KI
D. K2Cr2O7, Na2S2O3
E. KMnO4, KI
380. При визначенні окисників методом йодометрії при закінченні титрування спостерігають з крохмалем, як індикатором:
A. зникнення коричнево-оранжевого забарвлення розчину
B. зникнення зеленого забарвлення розчину
C. появу зеленого забарвлення осаду
D. *зникнення синього забарвлення
E. появу синього забарвлення
381. Вміст феруму (ІІ) можна визначити, застосовуючи пряме титрування за методом:
A. Аскорбінометрія
B. *Перманганатометрія
C. Титанометрія
D. Хромометрія
E. Йодометрія
382. Йодометричні визначення проводять в середовищі:
A. слабко кислому, нейтральному і слабко лужному
B. немає значення рН, оскільки іони Гідрогену не впливають на значення окиснювально-відновного потенціалу
C. нейтральному і слабко кислому
D. *нейтральному і слабко лужному
E. дуже кислому
383. Розчин натрій нітриту стандартизують за:
A. калій манганатом
B. сульфатною кислотою
C. сульфаміновою кислотою
D. *сульфаніловою кислотою
E. суфідною кислотою
384. У якому середовищі окислювальна здатність калій перманганату є більшою?
A. *У кислому
B. У лужному
C. У слабкокислому
D. У нейтральному
E. У слабколужному
385. Який продукт утворюється при окисненні натрій тіосульфату розчином йоду?
A. натрій сульфід
B. натрій персульфат
C. *натрій тетратіонат
D. натрій сульфат
E. натрій сульфіт
386. Який робочий розчин (титрант) використовують у методі біхроматометрії?
A. бромід хрому(ІІІ)
B. *дихромат калію
C. сульфат хрому(ІІІ)
D. нітрат хрому(ІІІ)
E. хромат калію
387. Титрантом методу перманганатометрії є 0,1моль/л розчин калій перманганату, який готують як вторинний стандартний розчин. Точну концентрацію калій перманганату встановлюють за:
A. Калій гідроксидом
B. *Оксидом арсену (ІІІ)
C. Натрій хлоридом
D. Калій дихроматом
E. Сульфатною кислотою
388. Титрантом в методі йодиметрії є стандартний розчин:
A. K2CrO4
B. KI
C. KIO3
D. *I2
E. Na2S2O3
389. Які умови проведення реакції, що використовують для стандартизації калій перманганату за оксалатною кислотою?
A. Будь-яке рН середовища
B. Кисле середовище, охолодження
C. Лужне середовище, нагрівання
D. *Кисле середовище, нагрівання
E. Нейтральне середовище, нагрівання
390. В якості індикаторів в методі біхроматометрії застосовують:
A. специфічні індикатори
B. необоротні окисно-відновні індикатори
C. кислотно-основні індикатори
D. металохромні індикатори
E. *редокс-індикатори
391. Вміст пероксиду водню без застосування індикаторів можна визначити, застосовуючи такий метод редоксиметричного титрування:
A. *Перманганатометрія
B. Йодиметрія
C. Церіметрія
D. Біхроматометрія
E. Хлорйодиметрія
392. Зміна забарвлення редокс-індикаторів пов’язана із:
A. Встановленням рівноваги окисненої і відновленої форм індикатора
B. Зміною концентрації іонів певних металів в розчині
C. Зміною кислотності розчинів і домінування кислотної чи основної форм індикатора
D. Домінуванням відповідної відновленої форми індикатора
E. *Встановленням деякого значення потенціалу в системі і відповідної редокс - рівноваги для індикатора
393. Який показник використовують для оцінки можливості перебігу окиснювально-відновних процесів?
A. *Значеннями редокс - потенціалів
B. Значенням ступеня окиснення металу
C. Числом прийнятих чи відданих електронів
D. Значення електронегативності елементів
E. Число іонів Гідрогену, що беруть участь в реакції
394. Який титрант потрібно брати для йодометричного визначення окисників?
A. розчин NaOH
B. розчин K2Cr2O7
C. *розчин Na2S2O3
D. розчин KMnO4
E. розчин I2
395. Який індикатор використовують у йодометрії при визначенні окисників?
A. розчин метилового червоного
B. розчин дифеніламіну
C. розчин хромогену чорного
D. розчин фенолфталеїну
E. *розчин крохмалю
396. Який робочий розчин використовують у методі, що називається ”нітритометрія“?
A. нітрат феруму (ІІІ)
B. нітрит амонію
C. *нітрит натрію
D. нітрат калію
E. нітрит магнію
397. Визначення масової частки новокаїну проводять методом нітритометрії, застосовуючи індикатор:
A. Редокс-індикаторів
B. Кислотно-основний (рН-індикатор)
C. Металохромний індикатор
D. *тропеолін з метиленовим синім
E. Адсорбційний (еозин, флуоресцеїн)
398. В методі йодиметрії застосовують в якості титранту розчин йоду, який є:
A. вторинним стандартним розчином, що стандартизується за натрій сульфітом
B. *вторинним стандартним розчином, що стандартизується за натрій тіосульфатом
C. первинним, а може бути вторинним стандартним розчином
D. вторинним стандартним розчином
E. первинним стандартним розчином
399. Необхідне значення рН середовища при визначенні масової частки пероксиду водню методом перманганатометрії створюють за допомогою:
A. *Сульфатної кислоти
B. Хлоридної кислоти
C. Ацетатної кислоти
D. Нітратної кислоти
E. Оксалатної кислоти
400. Умовами нітритометричних визначень є:
A. кисле середовище, присутність KBr і повільне титрування
B. сульфатно-кисле середовище, присутність KBr
C. *хлоридно-кисле середовище, присутність KBr і повільне титрування
D. повільне титрування (1 мл/хв)
E. кисле середовище і повільне титрування
401. Вміст вологи в препаратах, які мають підвищену чутливість до високих температур (термолабільні) визначають:
A. *Неводним титруванням по методу Фішера
B. Методом непрямої відгонки
C. Методом прямої відгонки
D. Броматометричним титруванням у водному середовищі
E. Методом відгонки
402. Напрям протікання окиснювально-відновних процесів визначається:
A. Природою окиснювально-відновних пар
B. Перебігом конкуруючих реакцій з учасниками окиснювально-відновного процесу
C. *Реальними (формальними) потенціалами окиснювально-відновних пар
D. Стандартними електродними потенціалами окиснювально-відновних пар
E. Термодинамічною константою рівноваги окиснювально-відновних реакцій
403. Як розраховується еквівалентна маса речовин в реакціях окиснення - відновлення?
A. Молярна маса ділиться на валентність металу
B. Молярна маса ділиться на добуток ступенів окиснення металу на число атомів металу
C. Молярна маса ділиться на число іонів гідроксиду, що беруть участь в реакції
D. Молярна маса ділиться на число іонів водню, що беруть участь в реакції
E. *Молярна маса ділиться на число електронів, що беруть участь в реакції
404. Яку реакцію використовують при кількісному визначенні пероксиду водню, використовуючи робочий розчин KMnO4?
A. реакцію комплексоутворення
B. *реакцію окиснення-відновлення
C. реакцію осадження
D. реакцію розчинення осаду
E. реакцію нейтралізації
405. Який стандартний розчин (титрант) використовують у методі перманганатометрії?
A. розчин BaCl2
B. *розчин KMnO4
C. розчин Na2S2O3
D. розчин K2Cr2O7
E. розчин H2SO4
406. Який стандартний розчин (титрант) потрібно брати для йодиметричного визначення відновників прямим титруванням?
A. NaOH
B. K2Cr2O7
C. Na2S2O3
D. *I2
E. KMnO4
407. Визначення концентрації натрій тіосульфату за калій біхроматом проводять, використовуючи в якості індикатора:
A. Метиленовий синій (0,1% розчин).
B. Амоній ферум (ІІІ) сульфат (насичений розчин).
C. *крохмаль (1% розчин).
D. метиловий червоний (0,1% розчин).
E. метиловий оранжевий (0,025 моль/л розчин)
408. Визначення концентрації натрій тіосульфату за калій біхроматом проводять, використовуючи в якості індикатора: Для визначення вмісту активного хлору в питній воді використовують метод:
A. Перманганатометрії
B. Кондуктометрії
C. *Йодометрії
D. Хроматометрії
E. Нейтралізації
409. Для визначення вмісту стрептоциду використовують метод нітритометрії. Титрант методу - розчин:
A. стандартизований розчин калій нітриту
B. стандартний розчин з приготовленим титром натрій сульфату
C. первинний стандарт натрій тіосульфату
D. *вторинний стандарт натрій нітриту
E. вторинний стандарт натрій нітрату
410. До досліджуваного розчину, що містить катіони кальцію, додали в надлишку розчину комплексонату магнію. Катіони магнію, що утворилися внаслідок реакції, відтитрували стандартним розчином трилону Б в присутності еріохром чорного Т. Виберіть формулу для розрахунку маси іону кальцію.
A. 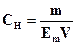
B. 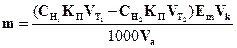
C. * 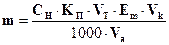
D. 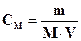
E. 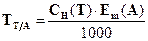
411. До досліджуваного розчину, що містить катіони кальцію, додали в надлишку розчину комплексонату магнію. Катіони магнію, що утворилися внаслідок реакції, відтитрували стандартним розчином трилону Б в присутності еріохром чорного Т. Який це вид титрування?
A. Зворотня трилонометрія
B. Пряма трилонометрія
C. Зворотнє комплексонометричне титрування
D. *Непряме комплексонометричне титрування
E. Пряме комплексонометричне титрування
412. Для комплексонометричного визначення сульфат-іону його спочатку осаджують у вигляді барій сульфату, діючи надлишком барій хлориду. Осад відокремлюють фільтруванням, а одержаний розчин (фільтрат) відтитровують розчином трилону Б. Який це вид титрування?
A. Замісникова трилонометрія
B. *Зворотнє комплексонометричне титрування
C. Пряма трилонометрія
D. Непряме комплексонометричне титрування
E. Пряме комплексонометричне титрування
413. Для комплексонометричного визначення сульфат-іону його спочатку осаджують у вигляді барій сульфату, діючи надлишком барій хлориду. Осад відокремлюють фільтруванням, а одержаний розчин (фільтрат) відтитровують розчином трилону Б. Виберіть формулу для розрахунку маси сульфат-іону.
A. 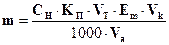
B. * 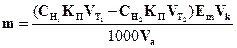
C. 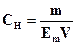
D. 
E. 
414. Для комплексонометричного визначення фосфат-іону його спочатку осаджують у вигляді амоній-магній фосфату. Осад відокремлюють і розчиняють в кислоті. До одержаного розчину додають аміачний буферний розчин і іони магнію відтитровують розчином трилону Б. Виберіть формулу для розрахунку маси фосфат-іону.
A. * 
B. 
C. 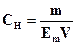
D. 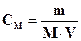
E. 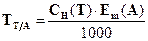
415. Для комплексонометричного визначення фосфат-іону його спочатку осаджують у вигляді амоній-магній фосфату. Осад відокремлюють і розчиняють в кислоті. До одержаного розчину додають аміачний буферний розчин і іони магнію відтитровують розчином трилону Б. Який це вид титрування?
A. Зворотня трилонометрія
B. Зворотнє комплексонометричне титрування
C. Пряма трилонометрія
D. *Непряме комплексонометричне титрування
E. Пряме комплексонометричне титрування
416. Виберіть специфічний індикатор для комплексонометричного визначення іонів бісмуту (ІІІ):
A. *Тіосечовина
B. Метиловий оранжевий
C. Фенолфталеїн
D. Сульфосаліцилова кислота
E. Сечовина
417. Виберіть специфічний індикатор для комплексонометричного визначення іонів феруму (ІІІ):
A. Фенолфталеїн
B. *Сульфосаліцилова кислота
C. Флюоресцеїн
D. Калій хромат
E. Сульфатна кислота
418. Які типи індикаторів використовуються в комплексонометричному титруванні?
A. Адсорбційні
B. Фероїн
C. Редоксіндикатори
D. рН-індикатори
E. *Металохромні
419. При комплексонометричному визначенні кальцію з кальконкарбоновою кислотою титрування припиняють при:
A. Зміні забарвлення від червоно-фіолетового до зеленувато-синього
B. Зникненні каламуті
C. Появі каламуті
D. *Зміні забарвлення від червоно-фіолетового до голубого
E. Утворенні осаду білого кольору
420. В методі ціанідометрії кінцеву точку титрування фіксують за допомогою:
A. Фероїну
B. Дифенілкарбазону
C. *Суспензії арґентум йодиду
D. Калій хромату
E. Розчину арґентум нітрату
421. Ціанідометричне титрування проводять:
A. В присутності натрій гідроксиду
B. В присутності калій гідроксиду
C. В сульфатнокислому середовищі
D. *В аміачному розчині
E. В хлориднокислому середовищі
422. Виберіть титрант ціанідометрії:
A. *Вторинний стандартний розчин калій ціаніду
B. Первинний стандартний розчин ціанідної кислоти
C. Вторинний стандартний розчин калій тіоціаніду
D. Вторинний стандартний розчин ціанідної кислоти
E. Первинний стандартний розчин калій ціаніду
423. При кількісному визначенні солей цинку ціанідометричним титруванням в присутності суспензії арґентум йодиду титрування припиняють при:
A. *Зникненні каламуті
B. Появі рожевого забарвлення розчину
C. Утворенні осаду синього кольору
D. Появі каламуті
E. Утворенні осаду білого кольору
424. Перед проведенням титрування нікель сульфату розчином калій ціаніду до розчину визначуваної речовини необхідно додати
A. Сульфатну кислоту
B. *Амоній гідроксид
C. Калій гідроксид
D. Хлоридну кислоту
E. Амоній карбонат
425. Для кількісного визначення торію використовують методи комплексиметрії. Який саме метод можна використати?
A. Меркурометрія
B. Броматометрія
C. Меркуриметрія
D. Йодометрія
E. *Фторидометрія
426. Для кількісного визначення цирконію використовують методи комплексиметрії. Який саме метод можна використати?
A. Аргентометрія
B. Меркуриметрія
C. Меркурометрія
D. *Фторидометрія
E. Ціанідометрія
427. Для кількісного визначення кальцію до аліквоти розчину додають надлишок натрій фториду, залишок натрій фториду відтитровують розчином солі алюмінію. Виберіть формулу для розрахунку маси визначуваної речовини.
A. 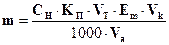
B. * 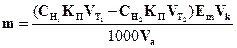
C. 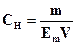
D. 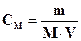
E. 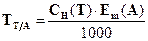
428. Виберіть індикатори фторидометричного титрування:
A. *Метиловий оранжевий, алізарин сульфат
B. Це без індикаторний метод
C. Алюмінон, метиловий оранжевий
D. Алюмінон, алізарин сульфат
E. Метиловий оранжевий, фенолфталеїн
429. Титрантом фторидометрії є:
A. Вторинний стандартний розчин калій фториду
B. Вторинний стандартний розчин фторидної кислоти
C. *Первинний стандартний розчин натрій фториду
D. Первинний стандартний розчин фторидної кислоти
E. Вторинний стандартний розчин натрій фториду
430. При визначенні тіоціанатів меркуриметрично як індикатор використовують:
A. Солі феруму (ІІ)
B. Дифеніламін
C. Метиловий оранжевий
D. *Солі феруму (ІІІ)
E. Це без індикаторний метод
431. До індикаторів меркуриметрії належать:
A. *Натрій пентаціанонітрозоферат (ІІІ) і дифенілкарбазон
B. Натрій нітропрусид і алізарин
C. Натрій нітропрусид і арґентум йодид
D. Не вимагає використання індикаторів
E. Дифенілкарбазон і калій хромат
432. Виберіть безіндикаторний метод комплексиметрії.
A. Комплексонометричне визначення йонів Кальцію
B. Ціанідометричне визначення Нікелю
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2593; Нарушение авторских прав?; Мы поможем в написании вашей работы!