
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль. 2. Кількісний аналіз 10 страница
|
|
|
|
E. комплексоутворення
658. До безіндикаторних методів осаджувального титрування належать:
A. метод Мора
B. *метод до точки просвітлення
C. метод Фаянса-Ходакова
D. меркурометрія
E. метод Фольгарда
659. Як називається метод, який базується на реакціях осадження галогенів у вигляді малорозчинних солей ртуті?
A. Цериметрією
B. Меркуриметрією
C. Роданометрією
D. *Меркурометрією
E. Аргентометрією
660. Для визначення масової частки натрію хлориду в ізотонічному розчині використовують метод прямого титрування за методом Мора. Титрування проводять у присутності індикатора:
A. Розчину натрію еозинату (0,1 моль/л)
B. Спиртового розчину дифенілкарбазону (W = 1-2 %)
C. *Розчину калію хромату (W = 5 %)
D. Розчину флуоресцеїну (W = 0,5 %)
E. Насиченого розчину амоній ферум (ІІІ) сульфату
661. Сульфатометрія - метод осаджувального титрування, яким визначають вміст Ba2+ або SO42-. Титрантами цього методу є розчини:
A. К2SO4 i BaCl2
B. Na2SO4 i BaCO3
C. BaSO4 i H2SO4
D. *Н2SO4 i Ba(NO3)2
E. Na2SO4 i H2SO4
662. Перевагою методу Фольгарда порівняно з методом Мора:
A. розчин титранту є первинним стандартом
B. можливість маскування заважаючих іонів
C. можливість використання додаткових титрантів
D. *можливість титрування в кислих розчинах
E. можливість титрування більшої кількості іонів
663. Метод Фаянса-Ходакова застосовується для визначення іонів:
A. аргентуму
B. сульфатів і хроматів
C. хроматів
D. *бромідів і йодидів
E. йодидів
664. Титрантом методу Мора є:
A. стандартний розчин NH4SCN
B. *вторинний стандартний розчин AgNO3
C. первинний стандартний розчин AgNO3
D. вторинний стандартний розчин NaCl
E. первинний стандартний розчин NaCl
665. До адсорбційних індикаторів, які застосовуються в методі Фаянса-Ходакова належать:
A. дифенілкарбазон
B. натрію нітропрусид
C. калію тіоціанат
D. калію хромат
E. *еозин
666. В осаджувальному титруванні застосовуються реакції, які:
A. проходять селективно і стехіометрично
B. *проходять кількісно, швидко, стехіометрично
C. проходять за короткий, але визначений час
D. проходять стехіометрично
E. проходять кількісно і швидко;
667. До 10,0 мл 0,1 моль/л розчину натрію хлориду додали 10,1 мл 0,1 моль/л розчину аргентум нітрату в присутності калій хромату. Яким буде забарвлення розчину чи осаду:
A. Білий осад і жовтий розчин над ним
B. Осад залишиться білим, сирнистим на вигляд
C. Розчин змінить забарвлення з жовтого на оранжево-червоний
D. Розчин залишиться слабко-жовтим
E. *Осад набуде червоно-коричневого кольору
668. Що є робочим розчином (титрантом) під час фіксування точки еквівалентності за способом Фольгарда?
A. Дихромат калію
B. Хромат калію
C. Хлорид срібла
D. *Тіоціанат амонію
E. Хлорид натрію
669. Яка речовина є індикатором під час аргентометричного визначення іонів хлориду по методу Мора?
A. Дихромат калію
B. *Хромат калію
C. Еозин
D. Флюоресцеїн
E. Залізоамонійні галуни
670. Для визначення масової частки натрію хлориду в лікарському препараті використовують метод прямого титрування за методом Фаянса-Ходакова. Титрування проводять у присутності індикатора:
A. Розчину натрію еозинату (0,1М).
B. Спиртового розчину дифенілкарбазону (w=1-2 %).
C. Амонію заліза (ІІІ) сульфату, насиченого розчину.
D. *Розчину флуоресцеїну (w=0,5%).
E. Розчину калію хромату (w=5%).
671. Перевагою меркурометрії порівняно з аргентометрією є:
A. *вища точність, можливість визначення в кислих розчинах і менша кількість заважаючих іонів
B. не заважають багато іонів металів та аніонів кислот
C. можливість титрування в кислому середовищі
D. вища чутливість і точність визначення
E. вища точність і ширші межі рН титрування
672. Зворотнім титруванням по методу Фольгарда можна визначати вміст:
A. аніонів
B. Ag+-іонів
C. *галогенід- і тіоціанат-іонів
D. катіонів металів
E. хлоридів і бромідів
673. У методі Фаянса-Ходакова титрантом є розчин:
A. *AgNO3, який є вторинним стандартом
B. NaCl, який є вторинним стандартом
C. K2CrO4, який є первинним стандартом
D. NaCl, який є первинним стандартом
E. AgNO3, який є первинним стандартом
674. До безіндикаторних методів осаджувального титрування належать:
A. метод Мора
B. *метод Гей-Люссака
C. метод Фаянса-Ходакова
D. меркурометрія
E. метод Фольгарда
675. До осаджувальних індикаторів, які застосовуються у методі осадження належать:
A. *калію хромат
B. еозин
C. ферум (ІІІ) сульфат
D. калію тіоціанат
E. калію ціанід
676. В осаджувальному титруванні використовуються реакції утворення важкорозчинних електролітів, для яких ДР є:
A. меншим 10-5
B. меншим 10-6
C. *меншим 10-10
D. більшим 10-10
E. більшим 10-6
677. При визначенні вмісту натрію хлориду в ін’єкційних розчинах, які є нейтральними за реакцією середовища розчинами, ДФУ рекомендує використовувати:
A. Метод кислотно-основного титрування
B. Метод Фаянса-Ходакова
C. Метод Гей-Люссака
D. Метод Фольгарда
E. *Метод Мора
678. Який аналітичний сигнал спостерігається під час фіксування точки еквівалентності в методі Фаянса?
A. Випадання осаду жовтого кольору
B. *Забарвлення осаду в малиновий колір
C. Забарвлення розчину у жовтий колір
D. Забарвлення розчину у червоний колір
E. Випадання осаду бурого кольору
679. У методах титриметричного аналізу використовують реакції окислення-відновлення; комплексоутворення; осадження; нейтралізації тощо. Яку реакцію використовують при аргентометричному титруванні?
A. реакцію комплексоутворення
B. реакцію нейтралізації
C. реакцію окислення-відновлення
D. *реакцію осадження
E. реакцію окислення бромідів до вільного брому
680. При титруванні слабкої кислоти розчином натрій гідроксиду (неводне кислотно-основне титрування) в присутності тимолового синього другий перехід забарвлення буде:
A. Від червоного до синього
B. *Від жовтого до синього
C. Від червоного до жовтого
D. Від безбарвного до рожевого
E. Від червоного до жовтого
681. При титруванні слабкої кислоти розчином метилату натрію (неводне кислотно-основне титрування) в присутності тимолового синього другий перехід забарвлення буде:
A. Від червоного до синього
B. Від червоного до жовтого
C. *Від жовтого до синього
D. Від безбарвного до рожевого
E. Від червоного до жовтого
682. Для визначення масової частки аргентум нітрату в лікарському препараті використовують метод прямого титрування за методом Фольгарда. Титрування проводять у присутності індикатора:
A. *Амонію заліза (ІІІ) сульфату, насиченого розчину.
B. Спиртового розчину дифенілкарбазону (W = 1-2 %).
C. Розчину флуоресцеїну (W = 0,5 %).
D. Розчину калію хромату (W = 5 %).
E. Розчину натрію еозинату (C = 0,1 моль/л).
683. При титруванні слабкої кислоти розчином натрій гідроксиду (неводне кислотно-основне титрування) в присутності тимолового синього перший перехід забарвлення буде:
A. Від синього до червоного
B. Від червоного до синього
C. Від синьо-зеленого до фіолетового
D. *Від червоного до жовтого
E. Від фіолетового до синьо-зеленого
684. При титруванні слабкої кислоти розчином метилату натрію (неводне кислотно-основне титрування) в присутності тимолового синього перший перехід забарвлення буде:
A. *Від червоного до жовтого
B. Від червоного до синього
C. Від синьо-зеленого до фіолетового
D. Від фіолетового до синьо-зеленого
E. Від синього до червоного
685. При титруванні слабкої основи розчином перхлоратної кислоти (неводне кислотно-основне титрування) в присутності тимолового синього титрування припиняють при зміні забарвлення:
A. Від синього до червоного
B. Від фіолетового до синьо-зеленого
C. Від синьо-зеленого до фіолетового
D. *Від жовтого до рожевого
E. Від рожевого до жовтого
686. Для визначення слабких кислот методом неводного кислотно-основного титрування як титрант використовують:
A. *CH3ONa в суміші C6H6 i CH3OH
B. NaOH в H2O
C. KOH в H2O
D. HClO2 в CH3COOH
E. CH3ONa в H2O
687. Для визначення слабких кислот методом неводного кислотно-основного титрування як титрант використовують:
A. CH3OH в C6H5OH
B. NaOH в CH3COONa
C. HClO4 в CH3COONa
D. CH3OH в C6H6
E. *NaOH в суміші C6H6 i CH3OH
688. Для визначення слабких кислот методом неводного кислотно-основного титрування як титрант використовують:
A. HClO4 в CH3COOH
B. NaOH в CH3COONa
C. *CH3ONa в CH3OH
D. CH3ONa в H2O
E. NaOH в H2O
689. Для визначення слабких кислот методом неводного кислотно-основного титрування як титрант використовують:
A. Метилат кальці ю в суміші бензолу і метанолу
B. Натрій гідроксид в розчині метанової кислоти
C. Водний розчин натрій гідроксиду
D. *Метилат натрію в суміші бензолу і метанолу
E. Водний розчин калій гідроксиду
690. Виберіть титрант неводного кислотно-основного титрування для визначення слабких основ:
A. HClO4 в H2О
B. H2SO4 в H2О
C. *HClO4 в CH3COOH
D. HCl в H2О
E. HClO2 в CH3COOH
691. При титруванні слабкої основи розчином перхлоратної кислоти (неводне кислотно-основне титрування) в присутності кристалічного фіолетового титрування припиняють при зміні забарвлення:
A. Від синього до червоного
B. *Від фіолетового до синьо-зеленого
C. Від синьо-зеленого до фіолетового
D. Від жовтого до рожевого
E. Від рожевого до жовтого
692. Для визначення слабких кислот методом неводного кислотно-основного титрування як титрант використовують:
A. Натрій гідроксид в бензолі
B. *Метилат натрію в метанолі
C. Водний розчин натрій гідроксиду
D. Натрій гідроксид в розчині льодяної ацетатної кислоти
E. Саліцилат натрію в метанолі
693. Для визначення слабких кислот методом неводного кислотно-основного титрування як титрант використовують:
A. Водний розчин калій гідроксиду
B. Натрій гідроксид в розчині льодяної ацетатної кислоти
C. Водний розчин натрій гідроксиду
D. Розчин перхлоратної кислоти в ацетатній кислоті
E. *Натрій гідроксид в суміші бензолу і метанолу
694. Для стандартизації перхлоратної кислоти в неводному кислотно-основному титруванні використовують:
A. *Калій гідрофталат
B. Натрій карбонат
C. Калій гідроксид
D. Натрій гідрокарбонат
E. Натрій тетраборат
695. Для визначення слабких основ методом неводного кислотно-основного титрування як титрант використовують:
A. Розчин сульфатної кислоти
B. *Розчин перхлоратної кислоти в ацетатній кислоті
C. Розчин хлоридної кислоти
D. Водний розчин перхлоратної кислоти
E. Розчин хлоритної кислоти в ацетатній кислот
696. Для кількісного визначення слабких кислот використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. Дистильовану воду
B. Мурашина кислота
C. Оцтовий ангідрид
D. *н-Бутиламін
E. Етанова кислота
697. Для кількісного визначення слабких кислот використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. *Піридин
B. Оцтовий ангідрид
C. Дистильовану воду
D. Концентрована ацетатна кислота
E. Форміатна кислота
698. Для кількісного визначення слабких кислот використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. Ангідрид етанової кислоти
B. Дистильовану воду
C. *Етилендіамін
D. Льодяна оцтова кислота
E. Метанова кислота
699. Серед наведених нижче індикаторів виберіть індикатори неводного кислотно-основного титрування:
A. *Тимоловий синій і кристалічний фіолетовий
B. Дифенілкарбазид і метилоранж
C. Фероїн і метиловий червоний
D. Фенолфталеїн і лакмус
E. Кристалічний фіолетовий і фенолфталеїн
700. Серед наведених нижче індикаторів виберіть індикатор неводного кислотно-основного титрування:
A. Метиловий червоний
B. *Тимоловий синій
C. Дифенілкарбазид
D. Лакмус
E. Метилоранж
701. Для кількісного визначення слабких кислот використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. Дистильовану воду
B. *Диметилфомамід
C. Льодяна ацетатна кислота
D. Мурашина кислота
E. Оцтовий ангідрид
702. Для кількісного визначення слабких основ використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. Диметилфомамід
B. н-Бутиламін
C. Піридин
D. *Оцтову кислоту
E. Етилендіамін
703. Для кількісного визначення слабких основ використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. Етилендіамін
B. н-Бутиламін
C. Диметилфомамід
D. Піридин
E. *Мурашина кислота
704. Для кількісного визначення слабких кислот використовують титрування в неводному середовищі. Який розчинник при цьому не використовується?
A. Етилендіамін
B. н-Бутиламін
C. *Льодяна ацетатна кислота
D. Піридин
E. Диметилфомамід
705. Для кількісного визначення слабких основ використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. *Льодяну ацетатну кислоту
B. н-Бутиламін
C. Етилендіамін
D. Піридин
E. Диметилфомамід
706. Для кількісного визначення слабких кислот використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. Амфіфільний розчинник
B. Можна любий розчинник
C. Протогенний розчинник
D. *Протофільний розчинник
E. Дистильовану воду
707. Для кількісного визначення слабких основ використовують титрування в неводному середовищі. Який розчинник при цьому краще використовувати?
A. Амфіфільний розчинник
B. Можна любий розчинник
C. *Протогенний розчинник
D. Протофільний розчинник
E. Дистильовану воду
708. Серед наведених нижче індикаторів виберіть індикатор неводного кислотно-основного титрування:
A. Метиловий оранжевий
B. Фероїн
C. Дифеніламін
D. Фенолфталеїн
E. *Кристалічний фіолетовий
709. Якщо після припинення титрування ацетатної кислоти розчином калій гідроксиду в розчині ще міститься ацетатна кислота, то похибка буде мати знак.... і буде розраховуватися за формулою:
A. „-”; 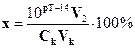
B. „-”; 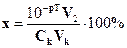
C. *„-”; 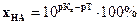
D. „+”; 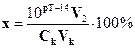
E. „+”; 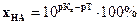
710. Якщо після припинення титрування амоній гідроксиду розчином хлоридної кислоти в розчині ще міститься амоній гідроксид, то похибка буде мати знак.... і буде розраховуватися за формулою:
A. „-”; 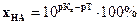
B. „-”; 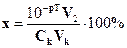
C. „+”; 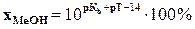
D. „+”; 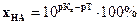
E. *„-”; 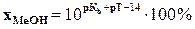
711. Якщо після припинення титрування сильної основи розчином сильної кислоти в розчині ще міститься ця основа, то похибка буде мати знак.... і буде називатися:
A. „+”; основною
B. „-”; кислотною
C. „-”; гідроксонієвою
D. „+”; кислотною
E. *„-”; гідроксильною
712. Якщо після припинення титрування натрій гідроксиду розчином сульфатної кислоти в розчині ще міститься ця натрій гідроксид, то похибка буде мати знак.... і буде розраховуватися за формулою:
A. „+”; 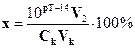
B. „+”; 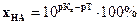
C. „-”; 
D. „+”; 
E. *„-”; 
713. Якщо після припинення титрування хлоридної кислоти розчином калій гідроксиду в розчині ще міститься хлоридна кислота, то похибка буде мати знак.... і буде розраховуватися за формулою:
A. „+”; 
B. „+”; 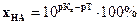
C. *„-”; 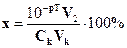
D. „+”; 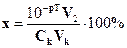
E. „-”; 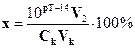
714. Якщо після припинення титрування сульфатної кислоти розчином калій гідроксиду в розчині ще міститься надлишок калій гідроксиду, то похибка буде мати знак.... і буде розраховуватися за формулою:
A. *„+”; 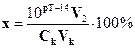
B. „+”; 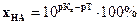
C. „-”; 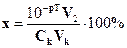
D. „+”; 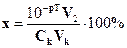
E. „-”; 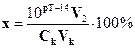
715. Якщо після припинення титрування натрій гідроксиду розчином хлоридної кислоти в розчині міститься надлишок хлоридної кислоти, то похибка буде мати знак.... і буде розраховуватися за формулою:
A. „+”; 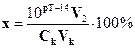
B. „+”; 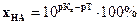
C. „-”; 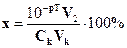
D. *„+”; 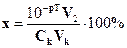
E. „-”; 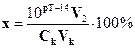
716. Якщо після припинення титрування сильної кислоти розчином сильної основи в розчині ще міститься ця кислота, то похибка буде мати знак.... і буде називатися:
A. „+”; основною
B. „-”; кислотною
C. *„-”; гідроксонієвою
D. „+”; кислотною
E. „-”; гідроксильною
717. Якщо після припинення титрування сильної кислоти розчином сильної основи в розчині міститься надлишок цієї основи, то похибка буде мати знак.... і буде називатися:
A. *„-”; гідроксильною
B. „-”; гідроксонієвою
C. „-”; основною
D. „+”; гідроксонієвою
E. „-”; кислотною
718. Якщо після припинення титрування сильної основи розчином сильної кислоти в розчині міститься надлишок цієї кислоти, то похибка буде мати знак.... і буде називатися:
A. „+”; кислотною
B. „-”; гідроксильною
C. „-”; гідроксонієвою
D. *„+”; гідроксонієвою
E. „-”; основною
719. Якщо після припинення титрування слабкої основи розчином сильної кислоти в розчині ще міститься ця основа, то похибка буде мати знак.... і буде називатися:
A. *„-”; основною
B. „-”; гідроксонієвою
C. „-”; гідроксильною
D. „+”; гідроксильною
E. „+”; основною
720. Якщо після припинення титрування слабкої кислоти розчином сильної основи в розчині ще міститься ця кислота, то похибка буде мати знак.... і буде називатися:
A. „+”; гідроксонієвою
B. *„-”; кислотною
C. „-”; основною
D. „+”; кислотною
E. „-”; гідроксонієвою
721. Якщо після припинення титрування слабкої кислоти розчином сильної основи в розчині ще міститься ця кислота, то похибка буде мати знак.... і буде розраховуватися за формулою:
A. „-”; 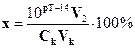
B. „-”; 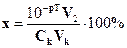
C. *„-”; 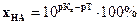
D. „+”; 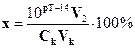
E. „+”; 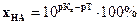
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1273; Нарушение авторских прав?; Мы поможем в написании вашей работы!