
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Питання для контролю знань. 1. Розрахувати величину періоду напівперетворення реакції омилення етилформіату, що є реакцією другого порядку
1. Розрахувати величину періоду напівперетворення реакції омилення етилформіату, що є реакцією другого порядку, якщо початкова концентрація естеру дорівнює 0,01 моль/л, а константа швидкості реакції дорівнює 1,93 × 10-1 л/с×моль.
2. Порівняти величини періодів напівперетворення (напіврозкладу) радіоактивних ізотопів тритію (12,26 років), радію (1590 років) і радону (3,825 дня) і зробити висновок про швидкість їх розкладу.
3. Показати, яке значення має закон Ламберта-Бугера-Бера для фотохімічних реакцій.
4. Вказати, які процеси слід вважати зворотними для реакції фотосинтезу і де вони відбуваються.
7. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006,
с. 450-456.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. К., Вища школа, 1986, с. 143, 164-166.
4. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М., Высшая школа, 1979, с. 72-73.
5. Равич-Щербо М.И., Новиков В.З. Физическая и коллоидная химия. М., Высшая школа, 1975, с. 110, 114-115.
1. ТЕМА. Особливості кінетики ферментативних процесів.
2. ОБҐРУНТУВАННЯ ТЕМИ. Кислотно-основний каталіз - дуже поширений вид гомогенного каталізу, у якому каталізаторами виступають катіони гідроксонію або гідроксид-іони. За таким механізмом відбуваються реакції гідролізу, омилення естерів, крохмалю, амідів та ін. У живому організмі такі реакції відбуваються під дією ферментів, активність яких залежить від концентрації катіонів гідроксонію або гідроксид-іонів. Активність ферментів взагалі залежить від концентрації ферменту та субстрату, рН, наявності речовин, які можуть бути активаторами або інгібіторами.
Велике значення має фактор екологічної чистоти живого організму та навколишнього середовища, екосистеми в цілому. Деякі речовини при попаданні в живий організм можуть не тільки тимчасово знизити активність ферменту, а і повністю блокувати його. Деякі лікарські засоби також можуть бути інгібіторами ферментів. Тому фармакологічні дослідження пов’язані з вивченням дії ліків на ферменти. Знання закономірностей ферментативних процесів необхідні студенту-медику для засвоєння відповідних розділів біохімії, гігієни, фармакології, спеціальних дисциплін.
3. МЕТА. Сформувати уявлення про кислотно-основний каталіз, залежність швидкості ферментативних процесів від концентрації, температури, наявності активаторів та інгібіторів.
Студент повинен знати:
- особливості кислотно-основного каталізу;
- характер залежності швидкості ферментативних процесів від концентрації ферменту та субстрату;
- принципи активації та інгібірування ферментів;
вміти:
- проводити теоретичний аналіз можливого впливу середовища на ферментативний процес.
4. ОРІЄНТОВНА КАРТКА ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ.
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Кислотно-основний каталіз. | 1.1. Механізм каталітичної дії іонів гідроксонію та гідроксид-іонів. |
| 2. Особливості кінетики ферментативних процесів. | 2.1. Залежність швидкості ферментативних процесів від концентрації ферменту та субстрату. Рівняння Міхаеліса-Ментен. 2.2. Вплив рН на швидкість ферментативних реакцій. |
| 3. Активація та інгібірування ферментів. | 3.1. Оборотне і необоротне інгібірування. 3.2. Види оборотного інгібірування. 3.3. Отруйні речовини як інгібітори ферментів. |
5. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ.
1) Вказати правильну характеристику кислотно-основного каталізу.
а) це реакції кислот і основ між собою;
б) це реакції кислот і основ, що відбуваються під дією каталізаторів;
в) це реакції, в яких кислоти та основи діють як каталізатори;
г) це реакції, в яких кислоти взаємодіють з основами тільки у присутності каталізатора.
2) Вибрати кінетичне рівняння розкладу фермент-субстратного комплексу FS з утворенням продукту і ферменту за теорією ферментативних реакцій Міхаеліса-Ментен.
а)  б)
б) 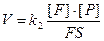 в)
в) 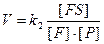 г)
г) 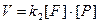
3) Охарактеризувати залежність швидкості ферментативної реакції від концентрації ферменту.
а) прямопропорційна; б) оберненопропорційна;
в) гіперболічна; г) експоненціальна.
4) Вибрати термін, який найбільше підходить для характеристики речовин, наявність яких у середовищі зменшує швидкість корозії металів.
а) каталізатори; б) інгібітори; в) каталітичні отрути; г) сенсибілізатори.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь в).
Кислотно-основний каталіз - це вид гомогенного каталізу, в якому каталізаторами є катіони гідрогену (гідроксонію) або аніони гідроксилу. Каталізатори переважно приєднуються до молекули реагуючої речовини, утворюючи проміжний комплекс, у якому відбувається перерозподіл електронної густини зв’язків. Потім цей комплекс розкладається, утворюються продукт реакції і вільний каталізатор.
2) Правильна відповідь а).
При виведенні кінетичного рівняння ферментативного каталізу Міхаеліса-Ментен припускалося, що розклад фермент-субстратного комплексу FS на продукт реакції Ρ і фермент F відбувається як реакція першого порядку:
k2
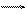
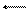 FS F + Ρ
FS F + Ρ
Отже, кінетичне рівняння цього розкладу матиме вигляд:
V = k2[FS]
3) Правильна відповідь а).
Згідно з кінетичним рівнянням Мехаеліса-Ментен:
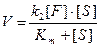
залежність швидкості ферментативної реакції від концентрації ферменту прямопропорційна.
4) Правильна відповідь б).
Для усунення або стримування корозії металів застосовують спеціальні речовини, які називаються інгібіторами корозії. Найчастіше це хромати, фосфати, нітрити, молібдати та ін. Вони додаються в агресивне, з точки зору можливої корозії, середовище або входять до складу захисного покриття на металевій конструкції.
|
|
Дата добавления: 2015-05-24; Просмотров: 312; Нарушение авторских прав?; Мы поможем в написании вашей работы!