
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Питання для контролю знань. 1. Які реакції називаються окисно-відновними.
|
|
|
|
1. Які реакції називаються окисно-відновними?
2. Що таке ступінь окиснення, окисник, відновник?
3. Які процеси називають окисненням, а які – відновленням?
4. Навести приклади найважливіших окисників та відновників.
5. Як визначають молярну масу еквівалента та молярну концентрацію еквівалента розчинів окисників та відновників?
6. На чому грунтується оксидиметрія та на які методи її поділяють?
7. Який робочий розчин та індикатор застосовують у методі перманганатометрії?
8. Які речовини кількісно визначають цим методом?
7. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006,
с. 336-344.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Селезнев К.А. Аналитическая химия. М., Химия, 1973, с. 236-244.
4. Бабков А.В. и др. Практикум по общей химии с элементами количественного анализа. М., Высшая школа, 1978, с. 129-140.
1. ТЕМА. Оксидиметрія. Метод йодометрії.
2. ОБҐРУНТУВАННЯ ТЕМИ. Йодометрія - одиніз найпоширеніших методів оксидиметричного титрування, оскільки є простим і точним методом. Застосовується у хімічних, клінічних та санітарно-гігієнічних дослідженнях, у першу чергу для визначення окисників і відновників у розчинах та біологічних рідинах. Наприклад, для визначення ферменту пероксидази у плазмі крові, "активного" хлору у хлорній воді, залишкового хлору у питній воді після хлорування. Застосовують йодометричний аналіз і для оцінки якості фармацевтичних препаратів, ліків, методом йодометрії визначають вміст альдегідної і кетонної груп, ацетону, хінону, гідрохінону, антипірину та ін. Знання методів оксидиметрії будуть, безумовно, корисними, при вивченні біохімії, фармакології, гігієни.
3. МЕТА. Ознайомитися з теорією та можливостями методу йодометрії. Засвоїти принципи зворотного йодометричного титрування.
Студент повинен знати:
- теоретичні основи методу йодометрії;
- суть прямого і зворотного титрування при визначенні відновників;
- суть методу заміщення при визначенні окисників;
вміти:
- складати рівняння окисно-відновних реакцій в методі йодометрії;
- проводити пряме і зворотне йодометричне титрування;
- виконувати розрахунки в йодометричному аналізі.
4. OPІЄHTОВHA КАРТKA ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Суть методу йодометрії. | 1.1. Реакції, що лежать в основі методу. 1.2. Робочі розчини. 1.3. Індикатор методу йодометрії. |
| 2. Визначення відновників методом йодометрії. | 2.1. Пряме титрування. 2.2. Зворотне титрування. |
| 3. Метод кількісного визначення окисників. | |
| 4. Методика кількісного визначення масової частки формальдегіду в формаліні. |
5. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
1) Які перетворення йоду лежать в основі методу йодометрії?
а) 2 I0з– + 12 Н+ + 10е– → I2 + 6Н2Ов) I2 + 2е-– → 2І– б) І–+ 3 Н2О - 6е– → I03– + 6 Н+ г) 2 І–– 2е–→ І2
2) Вказати, розчини яких речовин використовують як робочі в йодометрії.
а) йоду; в) тіосульфату натрію;
б) йодиду калію;г) крохмалю.
3) Чому при визначенні формальдегіду в формаліні застосовують зворотне титрування, а не пряме?
а) при прямому титруванні визначенню точки еквівалентності перешкоджає повільне проходження реакції;
б) пряме титрування з хімічної точки зору неможливе;
в) при прямому титруванні крохмаль не може застосовуватися як індикатор;
г) зворотне титрування скорочує час аналізу.
4) Визначити молярну масу еквівалента формальдегіду в його реакції з йодом.
а) 30 б) 15 в) 10 г) 6
5) Коли при зворотному йодометричному титруванні додають крохмаль?
а) на початку титрування тіосульфатом;
б) зразу після додавання розчину йоду;
в) коли при титруванні тіосульфатом йоду залишається дуже мало;
г) коли при титруванні тіосульфатом жовте забарвлення розчину зникає зовсім.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильні відповідів) і г).
При зворотному титруванні використовують окислювальні властивості молекулярного йоду, він реагує з відновником і сам відновлюється:
I2 + 2е–→ 2І–.
У методі заміщення при визначенні окисників застосовують відновлюючі властивості йодид-іонів, які еквівалентно відновлюють окисники, а самі окиснюються: 2 І– – 2е– → І2.
Сполуки, що містять йодат-іони IО3– – йодати, в йодометрії не використовуються.
2) Правильні відповіді а) і в).
У йодометрії як робочі розчини застосовують розчини йоду і тіосульфату натрію, концентрація яких точно визначається окремо спеціальним додатковим титруванням.
3) Правильна відповідьа).
Формальдегід з йодом у лужному середовищі реагує досить повільно, тому ця реакція не може бути основою для титрування.
4) Правильна відповідь б).
Взаємодія формальдегіду з йодом відбувається за рівнянням:
НСНО + 3 NаОН + I2 = НСООNа + 2 NaI + 2 H2O,
причому 1 моль формальдегіду окиснюється, віддаючи 2 електрони:
НСНО + 3 ОН– – 2е– → НСОО– + 2 Н2О
Тому молярна маса еквівалента формальдегіду буде дорівнювати:
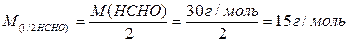
5) Правильна відповідь в).
Розчин крохмалю додають наприкінці титрування, коли йоду в розчині, який титрують, залишиться дуже мало, забарвлення розчину стає блідо-жовтим. Якщо додавати крохмаль раніше, при високій концентрації йоду, останній адсорбується на макромолекулах крохмалю, і його реакція з тіосульфатом буде йти надто повільно. Розчин при цьому можна перетитрувати.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 428; Нарушение авторских прав?; Мы поможем в написании вашей работы!