
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗАНЯТТЯ № 10
|
|
|
|
1. ТЕМА. Колоїдний захист.
2. ОБГРУНТУВАННЯ ТЕМИ. Явище колоїдного захисту має велике значення для нормального функціонування живого організму. Білки, полісахариди, деякі інші природні полімери адсорбуються на поверхні колоїдних гідрофобних частинок, збільшують їх гідрофільність і підвищують стабільність, захищаючи від коагулюючої дії електролітів. Частинки жиру, холестерину, нерозчинних фосфатів, уратів, оксалатів кальцію знаходяться у рідинах організму в такому “захищеному” стані. Захисна дія білків сприяє підвищенню концентрації нерозчинних речовин: протеїни сироватки крові збільшують “розчинність” карбонату кальцію майже в п¢ять разів, високий вміст в молоці фосфату кальцію також пов¢язаний з захисною дією білків. Деякі патологічні процеси, старіння організму змінюють концентрацію та захисні властивості білків, полісахаридів, що призводить до утворення холестериновик бляшок на стінках судин, каменів у нирках, сечовому та жовчному міхурах.
Явище колоїдного захисту використовується при виготовленні лікарських засобів. У медицині широко застосовують золі срібла (коларгол, протаргол, лізергін), золота, ртуті, радіоактивних ізотопів, захищених альбуміном, казеїном, желатиною, декстрином, пектинами.
3. МЕТА. Сформувати уявлення про механізм захисної дії природних високомолекулярних сполук, біологічну роль та застосування колоїдного захисту.
Студент повинен знати:
- суть явища колоїдного захисту;
- механізм захисної дії високомолекулярних сполук (ВМС);
- біологічну роль колоїдного захисту та його застосування у медицині;
вміти:
- розраховувати захисне число природного полімера;
оволодіти навичками;
- дослідження явища колоїдного захисту;
- визначення захисного числа желатини.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ,
НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про полімери. Білки і полісахариди як природні полімери.
(Матеріал шкільної програми з хімії).
2) Адсорбція на поверхні поділу фаз.
3) Будова колоїдних частинок.
4) Коагуляція колоїдних систем.
(Матеріал попередніх занять).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
Вплив ВМС на стабільність
 гідрофобних колоїдних систем
гідрофобних колоїдних систем


 Особливості Колоїдний захист Флокуляція
Особливості Колоїдний захист Флокуляція
будови ВМС
Захисне число ВМС Біологічна роль
колоїдного захисту
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Високомолекулярні сполуки (полімери). | 1.1. Особливості будови ВМС. 1.2. Полімери в організмі людини. |
| 2. Вплив високомолекулярних сполук на стабільність гідрофобних колоїдних систем. | 2.1. Колоїдний захист. 2.2. Захисне число ВМС. 2.3. Біологічна роль колоїдного захисту. 2.4. Флокуляція. |
| 3. Визначення захисного числа желатини для золю гідроксиду феруму (ІІІ) – залізного числа желатини. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вибрати відповідь, що правильно пояснює суть захисної дії ВМС:
а) молекули ВМС адсорбуються на поверхні колоїдних частинок і збільшують іх розміри, підвищуючи стабільність колоїдної системи;
б) молекули ВМС, одночасно адсорбуючись на декількох колоїдних частинках, сприяють утворенню більших за розмірами агрегатів;
в) молекули ВМС адсорбують на своїй поверхні йони електролітів, запобігаючи коагуляції колоїдної системи;
г) молекули ВМС, адсорбуючись на поверхні колоїдних частинок, сприяють утворенню більшої за розмірами гідратної оболонки.
2) Визначити захисне число білка, якщо при додаванні до 2 см3 золю 0,5 см3 розчину з масовою часткою білка 0,5% (r = 1 г/см3) спостерігалося явище колоїдного захисту.
а) 2,5 мг; б) 2,5 мг; в) 10,0 мг; г) 50,0 мг.
3) Вибрати речовини, які в організмі людини виконують захисну дію:
а) електроліти; б) холестерин; в) білки; г) полісахариди.
4) Вибрати фактори, від яких залежить захисна дія ВМС:
1 – природа ВМС, 2 – ступінь полімеризації ВМС; 3 – природа колоїдного розчину; 4 – природа електроліту, що викликає коагуляцію.
а) 1, 2, 3; б) 2, 3, 4; в) 1, 3, 4; г) 1, 2, 4.
5) Вказати, як називається процес зниження стійкості колоїдного розчину при додаванні невеликої кількості ВМС, недостатньої для захисної дії, що супроводжується осадженням дисперсної фази.
а) седиментація; б) флокуляція; в) флотація; г) взаємна коагуляція.
ПРАВИЛЬНІ ВІДПОВІДІ.
1) Правильна відповідь г).
Гідрофільні молекули ВМС, наприклад, молекули білка на ліпідних частинках у крові, адсорбуються на поверхні колоїдних частинок. При цьому частинка, що утворюється, хоча і стає більшою за розмірами і принципово менш стійкою, за рахунок великої гідратної оболонки набуває більшої стабільності. Оболонка запобігає злипанню колоїдних частинок під дією сил притягання при їх взаємному наближенні. В цілому гідрофобний золь стає гідрофільним.
2) Правильна відповідь б).
Визначимо масу білка у розчині:
m(білка) = 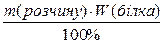 =
= 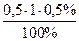 = 0,0025 г = 2,5 мг
= 0,0025 г = 2,5 мг
Розрахуємо захисне число (З.Ч.), яке дорівнює масі білка (мг), що захищає від коагуляції 10 см3 золю:
З.Ч. =  =
=  = 12,5 мг
= 12,5 мг
3) Правильні відповіді в) і г).
В організмі людини захисну дію виконують такі високомолекулярні сполуки: білки, поліпептиди, полісахариди. Вони адсорбуються на гідрофобних частинках фосфату та карбонату кальцію, ліпідів, інших важкорозчинних у воді сполук, набагато підвищуючи їх гідрофільність, а, значить, і стійкість.
4) Правильна відповідь а).
Захисна дія ВМС залежить від багатьох факторів. У першу чергу, це природа полімеру і колоїдного розчину, яка найбільше впливає на процес адсорбції. Крім того, захисна дія полімерів залежить від ступеня полімеризації ВМС, ступеня дисперсності частинок дисперсної фази, а для білків і поліпептидів – від рН колоїдного розчину. Природа електроліту, що викликає коагуляцію, є вторинним фактором, який впливає на процес коагуляції, а захисну дію адсорбованих молекул ВМС майже не змінює.
5) Правильна відповідь б).
При додаванні до колоїдних розчинів деяких видів ВМС (у першу чергу, поліелектролітів з лінійними молекулами) у невеликих кількостях, недостатніх для захисної дії, відбувається явище, яке називається флокуляцією. У таких випадках полімерні макромолекули окремими частинами ланцюга адсорбуються на різних колоїдних частинках, об¢єднуючи їх у єдиний агрегат. Стійкість таких агрегатів набагато менша, ніж окремих колоїдних частинок, тому спостерігається утворення осадів – флокулятів.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Перевірка захисної дії желатини.
Відміряти у дві колбочки по 10 см3 золю Fe(OH)3. Додати у першу колбочку з бюретки розчин з молярною концентрацією сульфату амонію 0,02 моль/л до перших ознак коагуляції (легке помутніння) і визначити об¢єм електроліту, потрібний для коагуляції. У другу колбочку додати 1см3 розчину желатини з масовою часткою 0,5%, а потім – такий же об¢єм розчину сульфату амонію, що і у першу колбочку. Відмітити, чи утворився каламутний розчин, тобто чи відбулася коагуляція. Зробити висновок про захисну дію желатини.
8.2. Визначення захисного числа желатини.
Приготувати розчини желатини у 7 пробірках. Для цього у першу пробірку налити 2 см3 розчину желатини з масовою часткою 1%, а в інші шість пробірок – по 1 см3 дистильованої води. Потім з першої пробірки перенести 1 см3 розчину у другу пробірку, після перемішування 1 см3 розчину з другої пробірки перенести у третю пробірку і так далі, а з сьомої пробірки, після перемішування, 1 см3 розчину вилити геть. Таким чином, у пробірках утворяться розчини желатини з концентраціями, що поступово зменшуються вдвічі.
Додати у кожну пробірку по 1 см3 золю Fe(OH)3, а після перемішування – по 1 см3 напівнасиченого розчину КСl.
Визначити, в яких пробірках відбулася коагуляція (утворення каламутності або осаду), а в яких спостерігається захисна дія желатини (відсутність помутніння). Результати спостереження занести у таблицю, відмітивши знаком “+ ” явище, що відбулося, і знаком “-“ явище, що не відбулося.
Визначити масу желатини (мг) у кожній пробірці. Припустивши, що густина розчину желатини дорівнює 1 г/см3, розрахувати масу желатини у першій пробірці за формулою: 
m(желатини) =  , мг
, мг
Маса желатини у кожній наступній пробірці буде вдвічі меншою, ніж у попередній. Значення мас желатини занести у таблицю.
| № пробірки | |||||||
| m(желатини), мг | |||||||
| Коагуляція | |||||||
| Колоїдний захист |
Визначити мінімальну масу желатини, що забезпечує захист золю від коагуляції і розрахувати “залізне число” – захисне число желатини для золю Fe(OH)3, як мінімальну масу желатини, що захищає від коагуляції 10 см3 (мл) золю.
З.Ч. = 
 , мг,
, мг,
де: m(желатини) – мінімальна маса желатини, мг.
8.3. Оформлення протоколу лабораторної роботи.
Записати у зошит розрахунки, заповнити таблицю та зробити висновки до кожного з дослідів.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 671-674.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я.
Биофизическая химия. -Київ: Вища школа, 1986.-С.234-237.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.
-М.: Высшая школа, 1975. –С. 214-215.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1157; Нарушение авторских прав?; Мы поможем в написании вашей работы!