
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗАНЯТТЯ № 4. 1 страница
|
|
|
|
1. ТЕМА. Хімічна рівновага. Добуток розчинності.
2. ОБҐРУНТУВАННЯ ТЕМИ. Життєдіяльність організмів базується на протіканні великої кількості біохімічних процесів. Більшість цих реакцій є рівноважними, або окремі стадії складних процесів - оборотні реакції. Наприклад, згідно з сучасною теорією кінетики ферментативних реакцій, утворення фермент-субстратного комплексу і його розклад на фермент і продукт реакції є оборотними процесами. Чітке усвідомлення особливостей рівноважного стану дуже важливе для розуміння поняття "стаціонарний стан відкритої системи" якою є живий організм. Знання теорії хімічної рівноваги необхідне для вивчення дії в організмі людини лікарських засобів та шкідливих речовин. Уявлення про хімічну рівновагу, константу рівноваги, вплив різних факторів на рівновагу потрібні студенту-медику для розуміння інших видів рівноваги в біологічних системах.
3. МЕТА. Засвоїти закономірності перебігу рівноважних процесів та можливості зміщення рівноваги в бажаному напрямку.
Студент повинен знати:
- основи теорії хімічної рівноваги;
- закон діючих мас для рівноважного стану;
- способи вираження константи рівноваги;
- принцип Ле-Шательє-Брауна;
- відмінність рівноважного стану системи від стаціонарного стану відкритої системи;
- суть поняття "добуток розчинності";
- умови утворення та розчинення осадів;
- роль гетерогенної рівноваги (за участю солей) у процесах метаболізму;
вміти:
- складати формальні рівняння для розрахунку константи рівноваги гомогенних та гетерогенних реакцій;
- визначати напрямок зміщення хімічної рівноваги при зміні температури, тиску, концентрації речовин;
- оцінювати рівноважний стан системи за величиною константи рівноваги та значенням зміни енергії Гіббса;
- проводити розрахунки з використанням добутку розчинності солей;
- оцінювати і співставляти розчинність сполук за величиною їхдобутку розчинності.
оволодіти навичками:
- зміщення хімічної рівноваги у бажаному напрямку шляхом зміни концентрації реагуючих речовин і температури.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ, НАВИЧКИ, НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про оборотні реакції. (Матеріал шкільної програми з хімії).
2) Швидкість реакції, константа швидкості реакції.
3) Закон діючих мас для швидкості гомогенних та гетерогенних реакцій. (Матеріал попереднього заняття).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
 Хімічна рівновага
Хімічна рівновага

Термодинаміка Константа рівноваги та Зміщення рівноваги рівноважного стану способи її вираження Принцип Ле-Шательє- Брауна

Дослідження зміщення рівноваги при утворенні роданіду заліза (ІІІ) та при зміні середовища у хромат-дихроматній системі.
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Хімічна рівновага як стан оборотних процесів. | 1.1. Значення енергії Гіббса як термодинамічна характеристика оборотних процесів. 1.2. Динамічний характер рівноважного стану. 1.2. Роль гетерогенної рівноваги за участю солей у загальному гомеостазі організму. |
| 2. Закон діючих мас для рівноважного стану. | 2.1. Константа рівноваги і способи її вираження. 2.2. Характеристика стану рівноваги по величині константи рівноваги. |
| 3. Зміщення хімічної рівноваги. | 3.1. Фактори, що впливають на зміщення рівноваги. 3.2. Принцип Де-Шательє-Брауна та його застосування для зміщення рівноваги у бажаному напрямку. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вибрати фактори, зміна яких призведе до зміни величини константи рівноваги:
а) тиск; б) температура; в) концентрація; г) природа реагуючих речовин.
2) Вказати, яке співвідношення утвориться між швидкостями прямої і зворотної реакцій, якщо об’єм реакційної посудини, у якій була встановлена рівновага:
 2SO2(г) + O2(г) 2SO3(г) зменшити у два рази.
2SO2(г) + O2(г) 2SO3(г) зменшити у два рази.
а) швидкості залишаться однаковими;
б) швидкість прямої реакції у 2 рази більша, ніж швидкість зворотної реакції;
в) швидкість прямої реакції у 2 рази менша, ніж швидкість зворотної реакції;
г) швидкість прямої реакції зросте у 1,5 рази відносно швидкості зворотної реакції.
3) Вибрати ті зміни параметрів, які призведуть до зміщення рівноваги у системі:
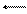
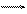 4НСl(г) + O2(г) 2Сl2(г) 2H2O(г) вліво.
4НСl(г) + O2(г) 2Сl2(г) 2H2O(г) вліво.
а) збільшення концентрації кисню;
б) збільшення концентрації хлору;
в) підвищення загального тиску;
г) зменшення об’єму реакційної посудини.
4) Вказати, в якому напрямку зміститься рівновага в системі:
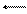
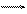 4Fe(T) + 3O2(г) 2Fe2О3(T) при збільшенні загального тиску.
4Fe(T) + 3O2(г) 2Fe2О3(T) при збільшенні загального тиску.
а) вліво; б) вправо; в) не зміститься.
5) Пояснити, який знак має зміна ентальпії рівноважної реакції:
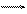
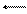 Н2О(г) Н2(г) + 1/2О2(г),
Н2О(г) Н2(г) + 1/2О2(г),
якщо при підвищенні температури величина константи рівноваги зростає.
а)ΔН > 0 б) ΔН < 0 в) ΔН = 0
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильні відповіді б) і г).
Константа хімічної рівноваги Κ є відношенням константи швидкості прямої реакції k1, до константи швидкості зворотної реакції k2: Κ = k1/k2.
Оскільки кожна з констант швидкості залежить лише від природи реагуючих речовин і температури, то константа рівноваги буде також залежати тільки від цих факторів. Зміна концентрації і тиску не викличе зміни константи рівноваги, але може призвести до зміщення рівноваги.
2) Правильна відповідь б).
У стані рівноваги швидкості прямої і зворотної реакцій були однаковими:
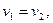
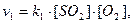 a
a 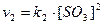
Внаслідок зменшення об’єму вдвічі концентрації або парціальні тиски газів збільшаться у 2 рази. Отже, швидкість прямої реакції зросте у 8 разів:

а швидкість зворотної реакції збільшиться у 4 рази:

Таким чином, швидкість прямої реакції буде вдвічі більшою, ніж швидкість зворотної реакції, і рівновага зміститься вправо.
3) Правильна відповідь б).
Згідно з принципом Ле-Шательє-Брауна, для того, щоб рівновага змістилася вліво, треба збільшити концентрацію продуктів реакції, в даному випадку або хлору, або пари води. Збільшення концентрації кисню призведе до зміщення рівноваги вправо. Збільшення загального тиску або зменшення об’єму викличе зміщення рівноваги вправо, у бік продуктів реакції, тому що кількість газоподібних речовин, які саме і обумовлюють тиск у системі, справа менша, ніж зліва.
4) Правильна відповідь б).
Це гетерогенна система, тиск у якій обумовлюють лише газоподібні молекули кисню. Збільшення у реакційній системі тиску призведе, згідно з принципом Ле-Шательє-Брауна, до зміщення рівноваги в бік меншої кількості газоподібних речовин, тобто вправо.
5) Правильна відповідь а).
Константа рівноваги, що дорівнює відношенню констант швидкостей прямої і зворотної реакції: K = k1/k2, показує, у скільки разів константа швидкості прямої реакції більша, ніж константа швидкості зворотної реакції.
Збільшення величини константи рівноваги можна охарактеризувати як зростання значення k1 відносно попереднього значення, тобто зросте швидкість прямої реакції порівняно зі значенням швидкості у рівноважному сталі. Це призведе до зміщення рівноваги вправо. Оскільки такий напрям зміщення обумовлений зростанням температури, пряма реакція буде ендотермічною і для неї ΔН > 0. Тобто, термохімічне рівняння матиме вигляд:
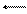
 H2O(г) H2(г) + 1/2О2(г), ΔН > 0
H2O(г) H2(г) + 1/2О2(г), ΔН > 0
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Визначення впливу зміни концентрації реагуючих речовин на зміщення хімічної рівноваги.
Залежність швидкості реакції в стані рівноваги від зміни концентрації реагуючих речовин і напрямок зміщення цієї рівноваги можна дослідити на прикладі оборотної реакції між хлоридом заліза(ІII) і роданідом амонію.
Змішати у колбі або стакані по 10 см3 розчину FеСl3 (молярна концентрація 0,002 моль/л) і розчину NH4CNS (молярна концентрація 0,006 моль/л). Одержаний розчин розлити у чотири пробірки. До розчину у першій пробірці додати 2см3 розчину FеСl3 (молярна концентрація 0,25 моль/л), до розчину у другій пробірці - 1 см3 розчину NH4CNS (молярна концентрація 0,6 моль/л), до розчину у третій пробірці - 1 см3 розчину NH4Сl (молярна концентрація 3,0 моль/л). Розчин у четвертій пробірці залишити для порівняння. Результати спостережень зміни забарвлення розчинів занести у таблицю:
| Речовина, розчин якої додається | Вид речовини за рівноважним станом | Зміна забарвлення | Напрямок зміщення рівноваги |
| 1. FeCl3 | вихідна речовина | ||
| 2. NH4CNH | вихідна речовина | ||
| 3. NH4Cl | продукт реакції |
Написати рівняння оборотної реакції між хлоридом заліза (III) і роданідом амонію. Написати формулу для розрахунку константи рівноваги згідно з законом діючих мас для рівноважного стану. Зробити висновок про напрямок зміщення рівноваги при збільшенні концентрації вихідних речовин і продуктів реакції.
8.2. Визначення впливу реакції середовища на стан рівноваги в системі хромат-іон - дихромат-іон.
У розчині, що містить аніонні форми хрому (VI), має місце рівновага між цими формами:
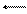
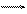 2CrO42- + 2H+ Cr2O72- + H2O
2CrO42- + 2H+ Cr2O72- + H2O
хромат-іон дихромат-іон
або:
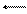
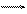 Cr2O72- + 2OH- 2CrO42- + H2O
Cr2O72- + 2OH- 2CrO42- + H2O
Зміна реакції середовища призводить до зміщення рівноваги, що видно по зміні забарвлення.
У хімічний стакан місткістю 100 см3 налити небагато оранжевого розчину дихромату калію K2Cr2О7 (w = 10%).До нього по краплях додати розчин лугу до зміни забарвлення на жовте. Потім до жовтого розчину хромату додати кілька крапель розчину сірчаної кислоти до появи оранжевого забарвлення.
Зробити висновок, вказавши, яка аніонна форма хрому (VI) є стійкою у кислому, а яка - у лужному середовищі.
8.3. Визначення впливу температури на стан хімічної рівноваги.
У водному розчині аміаку має місце рівновага:
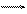
 NH3 + H2O H3 × H2O NH4+ + OH-
NH3 + H2O H3 × H2O NH4+ + OH-
У конічну колбу місткістю 100 см3 налити 30 см3 дистильованої води, додати декілька крапель концентрованого розчину аміаку і 2-3 краплі розчину фенолфталеїну. Рожевий розчин, що утворився, нагріти до зникнення забарвлення. Гарячий розчин обережно охолодити водою з-під крана і спостерігати відновлення рожевого забарвлення.
Зробити висновок про напрямок зміщення рівноваги у розчині аміаку при нагріванні та охолодженні.
8.4. Оформлення протоколу лабораторної роботи.
У зошиті запонити таблицю, написати необхідні рівняння реакцій та висновки до кожного з дослідів.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с.414-418, 176-184
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.Я., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. К., Вища школа, 1986, с. 29-33.
4. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М., Высшая школа, 1979, с. 80-92.
5. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высшая школа, 1975, с. 17-19.
Заняття № 5.
1. ТЕМА. Визначення окисно-відновного потенціалу.
2. ОБҐРУНТУВАННЯ ТЕМИ. Процес біологічного окиснення є основним джерелом енергії у живому організмі. Особливістю цього процесу є багатостадійність та поступове збільшення потенціалу відновника. Знання основних закономірностей окисно-відновних процесів, характеру зміни окисно-відновних потенціалів, напрямку переносу електронів (або атомів гідрогену) необхідні для розуміння окисно-відновних біохімічних процесів. Величина окисно-відновного біохімічного потенціалу дає змогу передбачити напрямок біологічного окиснення та розрахувати зміну енергії при цьому.
3. МЕТА. Сформувати уявлення про окисно-відновні потенціали та їх значення для напрямку перебігу окисно-відновних процесів. Оволодіти методикою визначення окисно-відновних потенціалів.
Студент повинен знати:
- теорію окисно-відновних потенціалів,їх значення для процесів окиснення-відновлення;
- принцип, за яким проводиться оцінювання сили окисника і відновника та визначається напрямок самодовільного окисно-відновного процесу;
- особливості поняття "стандартний біохімічний окисно-відновний потенціал" та його значення для напрямку процесів біологічного окиснення;
вміти:
- проводити розрахунки величини окисно-відновного потенціалу за рівнянням Нернста-Петерса;
- порівнювати силу окисників і відновників;
- визначати напрямок самодовільних окисно-відновних процесів.
оволодіти навичками:
- визначення окисно-відновних потенціалів окисно-відновних систем за допомогою платинового електрода.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Теорія окисно-відновних реакцій, методи складання окисно-відновних рівнянь.
2) Теорія електродних потенціалів, рівняння Нернста.
3) Поняття про гальванічні кола та типи електродів
(Матеріал попередніх занять з хімії).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
Окисно-відновні системи
 |  |
Окисно-відновні реакції Окисно-відновні потенціали
 | |||||||
 |  |  | |||||
Окисно-відновні реакції. Напрямок окисно- Стандартні окисно- Визначення
в живих організмах відновних реакцій відновні потенціали окисно-

 відновних
відновних
потенціалів
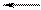 Напрямок реакцій Стандартні "біохімічні" окисно-
Напрямок реакцій Стандартні "біохімічні" окисно-
біологічного окиснення відновні потенціали
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Окисно-відновні системи | 1.1. Реакції в окисно-відновних системах та їх значення. 1.2. Окисно-відновні системи в живих організмах та біологічне окиснення. |
| 2. Поняття про окисно-відновні потенціали (редокс-потенціали) | 2.1. Механізм виникнення окисно-відновних потенціалів. 2.2. Рівняння Нернста-Петерса та фактори, що впливають на величину редокс-потенціалу. 2.3. Стандартний (нормальний) редокс-потенціал. 2.4. Практичне визначення редокс-потенціалу за допомогою платинового електрода. |
| 3.Визначення напрямку самодовільного перебігу окисно-відновних реакцій (редокс реакцій) | 3.1. Порівняння сили окисників і відновників взагалі та за стандартних умов. 3.2. Умови самодовільного перебігу окисно-відновних реакцій |
| 4. Реакції окиснення-відновлення в живих організмах | 4.1. Особливості біологічного окиснення. 4.2.Поняття про стандартний “біохімічний” редокс-потенціал. 4.3. Напрямок реакцій біологічного окиснення |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вибрати із наведених рівнянь реакцій рівняння окисно-відновних реакцій:
1. Аl2(SO4)3 + 6NаОН = 2Аl(ОН)з + 3 Na2SO4
2.2Аl + 2NаОН + 6 Н2О = 2 Nа[Аl(ОН)4] + 3 H2
3. АgNОз + NaI = NаNОз + АgІ
4. Cl2 + 2 NаІ = 2 NaCl + I2
а) 1,2 б) 2,3 в) 3,4 г) 2,4
2) Вибрати правильну характеристику окисно-відновного електрода:
а) це метал, що занурений у розчин елетроліту і обмінюється з ним іонами та електронами;
б) це інертний метал, що зануренийу розчин електроліту іобмінюється з ним електронами;
в) це інертний метал, що занурений в окисно-відновну систему і є лише провідником електронів;
г) це інертний метал, що занурений в окисно-відновну систему і обмінюється з нею іонами та електронами.
3) Вибрати окисно-відновну систему, потенціал якої залежить від рН:
а) Fe3+ + е- = Fe2+в) MnO4- + 8Н+ + 5е- = Mn2+ + 4H2O
б) MnO4-+ е- = MnO42- г) S4O62- + 2е- = 2 S2O32-
4) Вибрати дріб, що стоятиме під логарифмом у рівнянні Нернcта-ІІетерса для редокс-системи: СrO42– + 2 Н2О +3е– = СrО2– + 4 ОН–

5) Вказати, окислена форма якої окисно-відновної системи буде найбільш сильним окисником за стандартних умов:
а) НВrО + H+ + 2e– = Вr– + H2O φ ° = 1,34
б) СrО42-– + 4 Н2О + Зе– = Сr(ОН)3 + 5 ОН– φ° = - 0,13
в) 2 I03– + 12 Н+ + 10e– = I2 + 6 H2O φo = 0,19
г) H2O2 + 2 Н+ + 2е- = 2 H2O φo = 1,78
6) Пояснити, в якому напрямку за стандартних умов буде самодовільно йти реакція:
2 NaCI + Fе2(SO4)з = 2 FeSO4 + Cl2 + Na2SO4, якщо
φоСl2/2Cl- = 1,36 B, a φoFe3+/ Fe2+ = 0,771 B
а) зліва направо; в) реакція взагалі не буде йти;
б) справа наліво; г) реакція буде йти в обох напрямках.
7) Вибрати кращий окисник для перетворення Fе2+-іона за стандартних умов у Fе3+- іон, якщо стандартний потенціал φFe3+/ Fe2+ = 0,771 В, а стандартні потенціали окисників вказані в дужках:
а)KMnО4 (φ° = 1,51В); в) НNO2 (φ0 = 1,00 В);
б) КМnО4 в нейтральному середовищі(φ° = 0,58 В); г) CuSO4 (φ0 = 0,153 В).
8) Вказати, як зміниться ЕРС гальванічного кола Рв/Рв2+ //Аg+ /Аg,
якщо у розчин солі свинцю додати сірководень (у невеликій кількості);
а) зменшиться; в) не зміниться;
б) збільшиться;г) коло буде зіпсоване.
9) Вказати, який процес буде відбуватися на електроді з більшим потенціалом в окисно-відновному гальванічному колі:
а) залежить від природи електрода; в) окиснення;
б) відновлення; г) окиснення або відновлення.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь г).
Окисно-відновні реакції відбуваються із зміною ступенів окиснення елементів у молекулах реагуючих речовин.
2. 2Аl + 2 NaOH + 6 Н2О = 2 Nа [Al(OH)4] + 3 H2

 Аl + 4 ОH- - 3e- = [Аl(ОН)4]- 2 окиснення
Аl + 4 ОH- - 3e- = [Аl(ОН)4]- 2 окиснення
2 H2O + 2e- = H2 + 2 ОН- 3 відновлення
4. Cl2 + 2 NаІ = 2 NaCl + I2


 Cl2 + 2e- = 2 Сl- 1 відновлення
Cl2 + 2e- = 2 Сl- 1 відновлення
2 І- - 2e- = І2 1 окиснення
Реакції 1та 3 відбуваються без зміни ступенів окиснення атомів.
2) Правильна відповідь в).
Інертний метал (платина, золото, паладій та ін.) повинен знаходитися в розчині, що є окисно-відновною системою. Метал виконує роль провідника електронів: він із зовнішньої мережі передає електрони окисленій формі в розчині, або приймає електрони від відновленої форми і передає у зовнішню мережу. Таким чином, метал не обмінюється електронами й іонами з компонентами розчину.
3) Правильна відповідь в). У рівняння входять 8Н+ і потенціал буде залежати від рН (Т = 298 К)
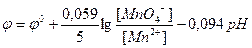
4) Правильна відповідь а).
Під логарифмом у чисельнику повинна стояти концентрація окисленої форми – СrО42-, а у знаменнику - відновленої: СrО2– і ОH–.
5) Правильна відповідь г).
Найбільш сильним окисником буде окислена форма тієї системи, яка має більше значення окисно-відновного потенціалу.
6) Правильна відповідь б).
Оскільки стандартний потенціал системи Сl2/2Сl- більший, окисником буде Сl2, а відновником - Fе2+. Такім чином, самодовільно реакція буде йти в напрямку справа наліво:
2 FeSO4 + Cl2 + Na2SO4 = 2 NaCl + Fе2(SО4)3, або 2 Fе2+ + Cl2 = 2 Сl- + + 2Fе3+
7) Правильна відповідь а).
Кращим окисником буде окислена форма редокс-системи, потенціал якої буде в більшій мірі перевищувати 0,771 В. Такою системою буде система, окислена форма якої – КМnО4 у кислому середовищі.
8) Правильна відповідь б).
EРС цього гальванічного кола розраховується за формулою:
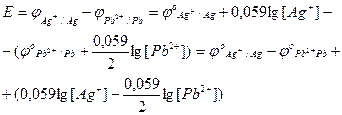
При додаванні сірководню у розчин, що містить іони Рв2+,, внаслідок реакції:
Pb2+ + H2S = PbS↓ + 2 Н+ концентрація катіонів Рb2+ зменшується.
Отже, у формулі EРС зменшиться lg [Рb2+], а різниця у дужках збільшиться,
що призведе до збільшення величини E, тобто ЕРС.
9) Правильна відповідь б).
На електроді з більшим потенціалом у гальванічному колі завжди буде відбуватися процес відновлення окисленої форми, яка буде окисником. Такий електрод є катодом і має від‘ємний заряд (-).
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
Окисно-відновні потенціали окисно-відновних систем обчислюють за значеннями ЕPC, що визначають на приладі іономірі ЭВ-74.
8.1. Підготовка до роботи та визначення ЕPC;
- перед підключенням іономіра до електричної мережі натиснути кнопки "t" і
"-І-І9";
- прогріти прилад протягом приблизно 30 хв.;
- зібрати гальванічне коло з вимірювального електрода (платиновий електрод ЭПВ-1) та допоміжного електрода (хлорсрібний електрод ЭВЛ-ІМ із сталим значенням потенціалу 0,201± 0,003 В);
- встановити електроди у спеціальний тримач над поворотним столиком і підключити до приладу;
- розчин досліджуваної окисно-відновної системи налити у скляний стакан і занурити у нього електроди;
- натиснути кнопну"mV" та кнопку потрібногодіапазону вимірювання і визначити величину EРС – E.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 374; Нарушение авторских прав?; Мы поможем в написании вашей работы!