
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль 2. 2 страница. Оскільки у формальне кінетичне рівняння для гетерогенних реакцій не входять концентрації речовин, що складають конденсовані фази
|
|
|
|
Оскільки у формальне кінетичне рівняння для гетерогенних реакцій не входять концентрації речовин, що складають конденсовані фази, і у лівій частині рівняння реакції тільки тверда речовина, кінетичне рівняння матиме вигляд: v = k. Тобто, з формальної точки зору, швидкість цієї реакції, за умови постійної температури, буде сталою величиною.
4) Правильна відповідь г).
Кінетичне рівняння для реакції матиме вигляд:
v = k × [NO]2 × [O2]
Внаслідок зменшення об’єму концентрація або парціальний тиск кожного з газів збільшується відповідно втричі. Отже, тепер швидкість буде дорівнювати:
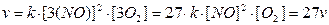
Тобто, швидкість реакції зросте у 27 разів.
5) Правильна відповідь б).
Загальний порядок реакції - це сума показників степенів концентрацій речовин у кінетичному рівнянні. У нашому випадку це 2 + 1 = 3
6) Правильна відповідь в).
Зміна швидкості реакції за правилом Вант-Гоффа залежить від зміни температури згідно з рівнянням: 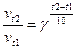
де: t1 i t2 - початкова і кінцева температури;
v t1 i v t2 - швидкість початкова і після зміни температури;
g - температурний коефіцієнт швидкості реакції.
Підставивши у рівняння відповідні дані, будемо мати:
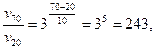 або
або 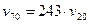
Тобто, швидкість реакції зросте у 243 рази.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Визначення впливу ступеня подрібнення речовин на швидкість гетерогенної реакції.
У суху пробірку насипати довільну порцію сухих кристалів солей Pb(NO3)2 і KI. Після повільного перемішування спостерігати, чи відбувається зміна забарвлення. Після цього суміш ретельно перетерти товкачиком у сухій фарфоровій ступці. Відзначити, як змінилося забарвлення. Потім до перетертої суміші додати декілька крапель дистильованої води і відзначити колір розчину, що утворився. Написати рівняння реакції та вказати речовину, що надає системі характерного забарвлення. Зробити висновок про вплив ступеня подрібнення речовин на швидкість реакції; порівняти швидкість гомогенної і гетерогенної реакцій.
8.2. Визначення залежності швидкості реакції від концентрації реагуючих речовин.
Дослід базується на реакції утворення нерозчинної у воді сірки за рівнянням:
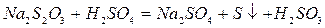
Використовуються розчини з молярною концентрацією еквівалента 1 моль/дм3.
У три колбочки (перша серія) налити розчини тіосульфату натрію і дистильованої води у співвідношеннях, що наведені у таблиці. У три інші пробірки (друга серія) відібрати по 10 мл розчину сірчаної кислоти. По черзі доливати розчин із пробірки (друга серія) до розчину у колбочці (перша серія), визначаючи час (τ) від моменту поєднання розчинів до моменту утворення ледве помітної каламутності. Одержані значення занести у таблицю. Розрахувати умовну швидкість реакції за формулою: 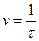
| Об’єм розчинів, мл | Час
 ,c ,c
| Умовна швидкість реакції v, C-1 | |
| Перша серія | Друга серія | ||
| 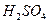
| ||
| - |
Зробити висновок про вплив концентрації реагуючих речовин на швидкість гомогенної реакції.
8.3. Визначення впливу температури на швидкість реакції.
Дослід також базується на реакції утворення нерозчинної у воді сірки за рівнянням:
Na2S2О3 + Н2SО4 = Nа2SО4 + S↓ + Н2SО3
Використовуються розчини з молярною концентрацією еквівалента 0,5 моль/дм3.
У три сухі пробірки налити по 5 мл розчину сірчаної кислоти (перша серія розчинів). У три інші пробірки - по 5 мл розчину тіосульфату натрію (друга серія). Визначити температуру розчинів термометром (вона однакова для обох розчинів). Злити разом розчин першої серії і розчин другої серії та визначити час до утворення ледь помітної каламутності. Решту підготовлених пробірок обох серій нагріти на водяній бані спочатку до температури, що на 10°С перевищує початкову. Знову злити два розчини обох серій і визначити час до утворення каламутності. Останні дві пробірки нагріти до температури, ще на 10° вищої. Зливши їх вміст, втретє визначити час до утворення каламутності.
Всі результати занести у таблицю і підрахувати умовну швидкість реакції для кожної температури.
| Температура t, 0C | Час
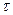 , c , c
| Умовна швидкість реакції v, c-1 |
Зробити висновок про те, як залежить умовна швидкість реакції від температури.
8.4. Оформлення протоколу лабораторної роботи.
Записати у зошит необхідні рівняння реакцій, заповнити таблиці, записати висновки до кожного з дослідів.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с.420-454.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовшчая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. К., Вища школа, I986, с. 140-149, 161-164.
4. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М., Высшая школа, 1979, с. 55-67, 70-73.
5. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высшая школа, 1975, с.101-118.
ЗАНЯТТЯ № 3.
1. ТЕМА. Кінетика біохімічних реакцій.
2. ОБГРУНТУВАННЯ ТЕМИ. У живій природі, промисловості, повсякденному житті велику роль відіграють каталітичні процеси. Каталізатори дозволяють значно прискорити швидкість реакції, одержати такий вихід продукту, який робить ефективним промислове добування. Необхідними для життя є біологічні каталізатори - ферменти, активність яких набагато більша, ніж активність неорганічних каталізаторів. Практично всі біохімічні реакції, як у найпростіших одноклітинних організмах, так і в організмі людини, мають ферментативний характер. Обмін речовин на клітинному рівні обумовлений каталітичною активністю ферментів. Визначення ферментативної активності все ширше застосовується у діагностиці захворювань внутрішніх органів. Наприклад, визначення активності фермента аспартат-амінотрансферази (АсАТ) у сироватці крові дозволяє з точністю до 96% діагнозувати інфаркт міокарда. Ферменти, їх активатори та інгібітори застосовують з лікувальною метою (ферментотерапія) та для вивчення патогенезу ряду захворювань.
Отже, уявлення про каталізатори і особливо ферменти, їх значення для живого організму необхідні студенту-медику для засвоєння біохімії, фармакології, нормальної та патологічної фізіології, спеціальних дисциплін.
3. МЕТА. Сформувати уявлення про механізм дії каталізаторів і ферментів, про особливості ферментативного каталізу та його роль у біохімічних процесах.
Студент повинен знати:
- визначення понять "каталіз" і "каталізатор";
- суть каталітичної дії;
- механізм гомогенного каталізу;
- особливості гетерогенного каталізу;
- особливості будови і механізму дії ферментів;
- роль ферментів у життєдіяльності організму, а також у діагностиці і лікуванні.
вміти:
- складати рівняння каталітичних реакцій;
- пояснювати за допомогою енергетичних діаграм суть каталітичної дії;
оволодіти навичками:
- визначення впливу каталізаторів на швидкість реакції.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Каталіз і каталізатори.
2) Поняття про гомогенний і гетерогенний каталіз. (Матеріал шкільної програми з хімії).
3) Швидкість реакції, енергія активації, прості і складні реакції.
4) Складання рівнянь окисно-відновних реакцій, (Матеріал попередніх занять з хімії).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
 Каталіз
Каталіз
 Види каталізу Суть каталітичної дії
Види каталізу Суть каталітичної дії


 Гомогенний Гетерогенний Ферментативний каталіз каталіз каталіз
Гомогенний Гетерогенний Ферментативний каталіз каталіз каталіз

 Теорія проміжних Будова Особливості Роль ферментів сполук ферментів дії ферментів у життєдіяльності
Теорія проміжних Будова Особливості Роль ферментів сполук ферментів дії ферментів у життєдіяльності
Вплив температури і рН Застосування ферментів у на активність ферментів діагностиці, лікуванні
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Суть і види каталізу. | 1.1. Види каталізу: гомогенний, гетерогенний, ферментативний (мікрогетерогенний). 1.2. Суть каталітичної дії. Зниження енергії активації у каталітичному процесі. 1.3. Теорія проміжних сполук у каталізі. 1.4. Особливості гетерогенного каталізу. 1.5. Автокаталіз. |
| 2. Ферменти як біологічні каталізатори. | 2.1. Поняття про будову ферментів. 2.2. Особливості дії ферментів як каталізаторів. 2.3. Вплив температури та рН на активність ферментів. 2.4. Поняття про механізм дії ферментів. 2.5. Роль ферментів у життєдіяльності організму та їх застосування у діагностиці і лікуванні. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Пояснити, чому при введенні каталізатора у систему змінюється швидкість реакції.
а) утворюються продукти реакції;
б) підвищується температура системи;
в) знижується енергія активації реакції;
г) змінюються концентрації реагуючих речовин.
2) Вибрати з наведених рівнянь реакцій рівняння гетерогенного каталізу.
CuO(т)
 а) CO(г) + 2Н2(р) СН3ОН(г)
а) CO(г) + 2Н2(р) СН3ОН(г)
NO(г)
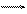 б) SO2(г) + 1/2 O2 SO3(г)
б) SO2(г) + 1/2 O2 SO3(г)
Na(т)
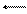
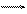 в) 2С2Н5ОН(р) С4Н9ОН(р) + Н2О(р)
в) 2С2Н5ОН(р) С4Н9ОН(р) + Н2О(р)
Н2О(р)
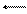
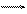 г) 3І2(т) + 2Al(т) 2AlI3(т)
г) 3І2(т) + 2Al(т) 2AlI3(т)
І2(г)
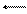
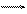 д) СН3СОН CH4(г) + СО(г)
д) СН3СОН CH4(г) + СО(г)
3) Вказати, у чому суть вибірковості (специфічності) дії ферментів.
а) у здатності прискорювати тільки певну конкретну реакцію;
б) у здатності прискорювати реакції даного типу (окиснення, гідроліз, приєднання);
в) у здатності прискорювати будь-яку реакцію даного субстрату;
г) у здатності прискорювати всі реакції, що відбуваються при певному значенні рН.
4) Пояснити відмінність наслідків значного підвищення температури для активності неорганічних каталізаторів і ферментів.
а) активність неорганічних каталізаторів переважно збільшується, а ферментів – зменшується;
б) активність неорганічних каталізаторів переважно збільшується, а ферментів – припиняється;
в) активність і неорганічних каталізаторів і ферментів збільшується;
г) активність неорганічних каталізаторів не змінюється, а ферментів - спочатку збільшується, а потім припиняється.
5) Вказати, як залежить активність фермента від зміни середовища.
а) зміна середовища не впливає на активність фермента;
б) зменшення рН збільшує активність фермента;
в) зміна середовища призводить до інактивації фермента;
г) зміна середовища може збільшити або зменшити активність
фермента в залежності від будови і природи фермента.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильна відповідь в).
Суть дії каталізатора, з сучасної точки зору, полягає в тому, що він проводить реакцію новим шляхом (найчастіше внаслідок утворення проміжної сполуки між каталізатором і однією з реагуючих речовин), для якого енергія активації значно нижча. Експериментально доведено, що для розкладу пероксиду водню на водень і кисень без каталізатора потрібно 75,3 кДж/моль енергії. При застосуванні колоїдної платини як каталізатора енергія активації знижується до 49,9 кДж/моль, а при дії фермента каталази - до 23 кДж/моль.
2) Правильні відповіді а), в), г).
При гетерогенному каталізі реагуючі речовини і каталізатор знаходяться у різних фазах, між ними є поверхня розділу фаз, на якій і відбувається реакція.
Реакції гомогенного каталізу б) і д) відбуваються у газовій фазі і взаємодія проходить у всьому об’ємі.
3) Правильна відповідь а).
Характерною особливістю каталізаторів єїх вибірковість або специфічність - здатність прискорювати тільки конкретну реакцію. Особливо яскраво проявляється вибірковість у ферментів. Так, фермент, що каталізує гідроліз сахарози, не каталізує гідроліз крохмалю, незважаючи на те, що і сахароза, і крохмаль – вуглеводи, і до складу їх молекул входить фрагмент Д-глюкози. Різні каталізатори або ферменти контролюють утворення різних продуктів з одних і тих же вихідних речовин. Так з етилового спирту можна одержати до 40 різних речовин. В організмі людини діють понад 100 різних ферментів. Вони утворюють складні ферментні системи, що забезпечують низку послідовних та узгоджених між собою перетворень. Відсутність високої специфічності ферментів призвела б до повного розладу систем організму.
4) Правильна відповідь б).
Дослідження показують, що неорганічні каталізатори збільшують активність при підвищенні температури. Більшість з них відмінно працює за умови високої температури (100-100°С). Ферменти здатні працювати у неширокому температурному діапазоні,
переважно 10 - 60°С, причому оптимальна температура для них - приблизно 40°С. При подальшому підвищенні температури активність ферментів падає, а при температурі вищій за 70°С ферменти втрачають активність, переважно внаслідок денатурації білкової структури.
5) Правильна відповідь в).
Ферменти проявляють свою активність у досить вузькому діапазоні значень рН. Так, уреаза активна при рН = 6,7, пепсин - при рН = 1,5 - 2,0; аргіназа - в інтервалі рН 9,5 - 9,9. Значна зміна величини рН, а тим більше, зміна середовища призведе до інактивації ферменту. Вплив реакції середовища на активність фермента пояснюється залежністю існування певної структури ферменту, що забезпечує його каталітичну активність, від величини рН, оскільки переважна більшість ферментів має білкову природу.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Відновлення перманганату калію в присутності каталізатора.
Налити у пробірку до половини об’єму розчин сірчаної кислоти (w = 30 %), додати три краплі розчину КМnO4 ( молярна концентрація еквівалента 0,1 моль/л). Розчин перемішати і, якщо він набув рожевого забарвлення, розлити у три пробірки.
У першу пробірку додати 1 краплю розчину КNO3, а потім у першу і другу пробірки внести по шматочку цинку. Третя пробірка залишається для порівняння забарвлення.
Порівняти швидкість знебарвлення розчину у першій і другій пробірках та зробити висновок, вказавши, яка речовина є каталізатором. Скласти рівняння реакції за схемою:
 Ζn + КМnO4 + Н2SO4 ZnSO4 + К2SO4 + MnSO4 + H2O
Ζn + КМnO4 + Н2SO4 ZnSO4 + К2SO4 + MnSO4 + H2O
8.2. Каталітичне відновлення роданіду заліза (III).
У дві пробірки налити по 3 мл розчину KCNS або NH4CNS і по З краплі розчину FeCl3. Утворюється роданід заліза (III) за реакцією:
3КСNS + FeСl3 = Fe(CNS)3 + 3КСl
В одну з пробірок додати 2 краплі розчину CuSO4, а потім в обидві пробірки - по 3 мл розчину тіосульфату натрію. Порівняти швидкість знебарвлення розчинів у пробірках і зробити висновок, яка речовина є каталізатором і який це вид каталізу. Скласти рівняння реакції за схемою:
 Fe(CNS)3 +Na2S2O3 Fe(CNS)2 + Na2S4O6 + NaCNS
Fe(CNS)3 +Na2S2O3 Fe(CNS)2 + Na2S4O6 + NaCNS
8.3. Розклад пероксиду водню в присутності гетерогенного каталізатора.
До 2 мл розчину пероксиду водню додати невелику кількість порошку РbO2 або МnO2. Спостерігати бурхливе виділення кисню. Написати рівняння реакції каталітичного розкладу пероксиду.
8.4. Автокаталітичне відновлення перманганату калію в кислому середовищі.
У конічну колбу налити 10 мл розчину щавлевої кислоти Н2С2O4 (w = 5% ), 5 мл розчину Н2SO4 (С = 0,1 моль/л). Потім однаковими порціями (по 0,2-0,5 мл) додавати з бюретки або піпетки розведений розчин перманганату калію, визначаючи час знебарвлення кожної порції.
Порівняти час знебарвлення першої порції перманганату калію знаступними і зробити висновок, вказавши, що є каталізатором. Скласти іонне рівняння реакції за схемою:
 H2C2O4 + MnO4- + H+ CO2 + Mn2+ + H2O
H2C2O4 + MnO4- + H+ CO2 + Mn2+ + H2O
8.5. Оформлення протоколу лабораторної роботи.
У зошит записати необхідні рівняння реакцій та висновки до кожного з дослідів.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с.457-486.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. К., Вища школа, 1986, с. 149-157
4. Ленский А.С. Введение в бионеорганическую и биофизическую химию. М., Высшая школа, 1979, с. 67-70, 73-79.
5. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М., Высшая школа, 1975, с. 118-129.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 373; Нарушение авторских прав?; Мы поможем в написании вашей работы!