
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗАНЯТТЯ № 7. 1.ТЕМА. Іонний обмін. Хроматографія
|
|
|
|
1.ТЕМА. Іонний обмін. Хроматографія.
2. ОБГРУНТУВАННЯ ТЕМИ. Хроматографія як фізико-хімічний метод аналізу широко застосовується в науковій та лабораторній практиці. Методами хроматографічного аналізу розділяють та ідентифікують амінокислоти, білки, нуклеїнові кислоти, ліпіди та інші біоорганічні сполуки; вони застосовуються для визначення складу промислових газоподібних і рідких викидів. У комплексі з іншими методами фізико-хімічного аналізу хроматографія є найважливішим методом дослідження в біології, медицині та фармації, методом екологічного контролю та моніторингу.
3. МЕТА. Сформувати уявлення про види, особливості та можливості хроматографії, напрямки її застосування у біохімічному, лабораторному, санітарно-гігієнічному аналізі. Набути практичних навичок у проведенні розподільної паперової хроматографії та адсорбційної хроматографії на твердому адсорбенті.
Студент повинен знати:
- суть хроматографічного аналізу;
- класифікацію хроматографічних методів за типом фізико-хімічного
процесу;
- основні види хроматографії за технікою виконання;
- можливості застосування хроматографії у біології, медицині, екології;
вміти:
- проводити якісну колоночну адсорбційну хроматографію;
оволодіти навичками:
- розділення та якісного визначення речовин методом розподільної
паперової хроматографії.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ ТА НАВИЧКИ,
НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про гідрофільність (полярність) і гідрофобність (неполярність) сполук.
2) Поняття про адсорбцію, розподіл речовин між двома фазами, що не змішуються.
3) Поняття про гетерогенну рівновагу на межі поділу фаз.
(Матеріал попередніх занять з хімії).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.

 Х р о м а т о г р а ф і я
Х р о м а т о г р а ф і я
Класифікація хроматографічних методів Застосування хроматогра-
за типом фізико-хімічного процесу та фії у біології, медицині,
 за технікою виконання фармації та екології
за технікою виконання фармації та екології
Розподільна паперова Адсорбційна колонкова хроматографія
хроматографія амінокислот на твердому адсорбенті
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів)
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Суть хроматографічного методу аналізу. | 1.1. Розділення сумішей та ідентифікація компонентів. Якісний та кількісний аналіз. |
| 2. Класифікація хроматографічних методів за типом фізико-хімічного процесу, на якому вони базуються. | 2.1. Адсорбційна хроматографія. 2.2. Розподільна хроматографія. 2.3. Йонообмінна хроматографія. 2.4. Осадова хроматографія. 2.5. Гель-фільтрація. |
| 3. Види хроматографічного аналізу за технікою виконання. | 3.1. Газова та газо-рідинна хроматографія. 3.2. Паперова та тонкошарова хроматографія. 3.3. Колоночна хроматографія. |
| 4. Можливості застосування хроматографії у біології, медицині, фармації, екології. | |
| 5. Методика розділення амінокислот за допомогою розподільної паперової хроматографії. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вибрати процеси, що лежать в основі хроматографічних методів дослідження:
1 – йонний обмін, 2 – розчинення у воді, 3 – адсорбція,
4 – випаровування, 5 – кристалізація, 6 – розподіл між двома фазами.
а) 1, 3, 4; б) 2, 3, 4, 6; в) 1, 3, 6; г) 2, 4, 5.
2) Вибрати методи хроматографічного аналізу, що базуються на розподілі компонентів суміші між двома рідкими фазами:
1 – газоадсорбційна хроматографія, 2 – паперова хроматографія,
3 – гель-хроматографія, 4 – адсорбційна колонкова хроматографія,
5 – тонкошарова хроматографія, 6 – йонообмінна хроматографія.
а) 2, 5; б) 4, 6; в) 1, 3; г) 1, 2.
3) Вказати, яка речовина є нерухомою фазою у паперовій хроматографії.
а) органічний розчинник; б) вода; в) целюлоза;
г) у паперовій хроматографії нерухомої фази немає.
4) Вказати параметри паперової хроматографії, які треба стандартизувати при точному визначенні факторів утримування компонентів суміші, що розділяється:
1-температура, 2-тиск, 3-кількість рухомої фази, 4-вид паперу, 5-розмір і форма паперу, 6-вид розчинника.
а) 3,5; б) 4,6; в) 1,3; г) 2,4.
5) Вказати, що характеризує величина фактору утримування у паперовій хроматографії.
а) відношення розчинностей компонентів у розчиннику;
б) відношення розчинностей компонентів у нерухомій фазі;
в) відношення швидкостей руху компонентів суміші;
г) відношення швидкостей руху компонента і розчинника.
6) Вказати вид хроматографії, що має спільний механізм дії з методом одержання прісної або демінералізованої води.
а) адсорбційна; б) розподільна; в) йонообмінна; г) осадова.
ПРАВИЛЬНІ ВІДПОВІДІ.
1) Правильна відповідь в).
Розчинення, випаровування та кристалізація не належать до процесів, на яких грунтується хроматографія.
2) Правильна відповідь а).
З наведених видів хроматографії тільки у паперовій та тонкошаровій компоненти суміші розподіляються між нерухомою фазою та розчинником (рухома фаза), який поступово рухається від стартової точки до краю паперу. Нерухомою фазою у паперовій хроматографії є волога фільтру, а у тонкошаровій хроматографії – рідина, якою попередньо просочують шар адсорбента.
3) Правильна відповідь б).
Вода, точніше волога паперу, є нерухомою фазою у паперовій хроматографії. Спеціальний хроматографічний папір містить більше 20% вологи.
4) Правильна відповідь б).
Від виду паперу (а не його розмірів і форми), виду розчинника залежать значення факторів утримування даних компонентів. Тиск і кількість розчинника, який завжди береться у надлишку для даних розмірів паперу, на значення факторів утримування не впливають. Температура теж не стандартизується, а береться трохи вищою за кімнатну.
5) Правильна відповідь г).
6) Правильна відповідь в).
Йонообмінна хроматографія, як і одержання демінералізованої або прісної води, базується на йонному обміні між йонами рідкої фази (води, розчину) та рухливими йонами йонообмінної смоли. У йонообмінній хроматографії застосовуються переважно або катіоніт (обмінюється катіонами) або аніоніт (обмінюється аніонами), а при одержанні демінералізованої води її пропускають послідовно через катіоніт і аніоніт, замінюючи катіони й аніони, що містяться у воді, на катіони Н+ та аніони ОН-.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Проведення адсорбційної хроматографії катіонів на оксиді алюмінію
Розділення катіонів Fe3+ та Сu2+ проводять за допомогою адсорбційної колоночної хроматографії. Підготувати колонку для хроматографії таким чином: взяти суху скляну трубку довжиною 12 – 15 см із внутрішнім діаметром біля 1 см, що має відтягнутий вузький кінець.
У цей кінець заштовхати трохи вати, а потім заповнити трубку порошком оксиду алюмінію на 4 – 5 см по висоті, періодично постукуючи по трубці, запобігаючи утворенню порожнеч. Підготовлену колонку вертикально закріпити у штативі. Відібрати приблизно по 3 см3 розчинів хлориду феруму(III) і сульфату купруму з однаковою молярною концентрацією еквівалента та змішати ці розчини у пробірці. Одержаний розчин обережно перелити у колонку. Знизу підставити пусту колбочку.
Через деякій час верхній шар адсорбента забарвиться у жовтий колір (катіони Fe3+), а нижче утвориться блакитний шар (катіони Сu2+).
Після того, як через адсорбент пройде весь розчин, для більшої наочності досліду, треба промити адсорбент невеликою кількістю води, а потім пропустити через колонку проявлювач – розведений розчин жовтої кров¢яної солі K4[Fe(CN)6]. Тоді верхній шар забарвиться у темно- синій колір, а шар катіонів купруму – у коричневий.
Зробити висновок про залежність адсорбції катіонів на оксиді алюмінію від заряду катіону. Колонку із забарвленими шарами катіонів намалювати у протоколі роботи.
8.2. Проведення розподільної хроматографії амінокислот на папері.
Готовий фільтр або коло фільтровального паперу діаметром 12 см розкреслити олівцем на 4 сектори: у трьох секторах на відстані 0,5 см від центру олівцем намітити місця старту, а у четвертому секторі вирізати вузький язичок, що доходить майже до центру (рис.3.3). З краю фільтра у трьох секторах зробити позначки: “гл” - гліцин, “сум” - суміш амінокислот, “лей” - лейцин.



 Гл Сум
Гл Сум







 Фронт
Фронт
 розчинника
розчинника








 Лейцин
Лейцин




 . Гліцин
. Гліцин




 Лей
Лей

 л Місце старту
л Місце старту
Рис.3.3. Рис.3.4.
Потім на місця старту нанести краплі відповідних розчинів: гліцину, лейцину та суміші цих амінокислот. Краплі не повинні бути більшими, ніж 3-4 мм у діаметрі. Нанести по 3-4 краплі поступово, підсушуючи попередню пляму перед нанесенням наступної краплі.
У чашку Петрі налити розчинник, покласти фільтр таким чином, щоб відігнутий язичок був занурений у розчинник. Зверху папір накрити другою чашкою Петрі та поставити у термостат з температурою 45-500С. Коли розчинник дійде майже до краю фільтра, вийняти папір, підсушити його у сушильній шафі та обробити проявником – розчином нінгідрину. Хроматограму підсушити у термостаті – на ній проявляться кольорові плями амінокислот.
За допомогою хроматограми визначити фактори утримування амінокислот гліцину та лейцину. Лінійкою відміряти відстань від місця старту до середини плями кожної з амінокислот та від місця старту до лінії фронту розчинника (рис. 3.4.).
Розрахувати фактори утримування (Rf) амінокислот за формулами: Rf(гліцину) = r1/rp, Rf(лейцину) = r2/rp,
Де: r1 – відстань від точки старту до середини плями гліцину, см;
r2 – відстань від точки старту до середини плями лейцину, см; rp – відстань від точки старту до лінії фронту розчинника, см.
Замалювати хроматограму, записати результати розрахунків та на їх основі зробити висновок про розподіл амінокислот у залежності від полярності молекул.
8.3. Оформлення протоколу лабораторної роботи.
Намалювати у зошиті колонку із забарвленими шарами катіонів. Записати висновок про залежність адсорбції катіонів на оксиді алюмінію від заряду катіону.
Замалювати хроматограму, записати результати розрахунків та висновок про розподіл амінокислот у залежності від полярності молекул.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с.594-601.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я.
Биофизическая химия. -Київ: Вища школа, 1986.-С.183 - 186.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.
-М.: Высшая школа, 1975. –С. 168 - 174.
ЗАНЯТТЯ № 8
1. ТЕМА. Одержання, очистка та властивості колоїдних розчинів.
2. ОБГРУНТУВАННЯ ТЕМИ. Живий організм можна розглядати як складну сукупність дисперсних систем. Низькомолекулярні електроліти та неелектроліти знаходяться у біологічних рідинах у вигляді істинних розчинів; білки, ліпіди, нуклеїнові кислоти, полісахариди утворюють колоїдно-дисперсні системи; клітини, форменні елементи крові, бактерії утворюють грубодисперсні системи. Зміна фізико-хімічного стану дисперсних систем в організмі може призвести до патології. Зсідання крові, перенесення ліпідів та водонерозчинних сполук, утворення холестеринових бляшок у судинах – ці та інші життєво важливі процеси базуються на властивостях дисперсних систем.
Дослідження дисперсних систем сприяло впровадженню у медичну практику таких сучасних інструментальних методів діагностики та лікування як електрофорез, компенсаційний та вівідіаліз, апарат “штучна нирка”.
Отже, майбутньому лікареві, безумовно, необхідно мати базові поняття про будову та властивості дисперсних систем та колоїдних розчинів зокрема.
3. МЕТА. Сформувати уявлення про методи добування та очищення, властивості колоїдних розчинів, їх використання у клінічній, фармацевтичній та санітарно-гігієнічній практиці. Набути практичних навичок в одержанні колоїдних розчинів та очистці їх методом діалізу.
Студент повинен знати:
- класифікацію дисперсних систем за агрегатним станом та розміром частинок дисперсної фази;
- основні методи одержання колоїдних розчинів;
- міцелярну теорію будови гідрофобних золей;
- молекулярно-кінетичні, електричні та оптичні властивості колоїдних розчинів;
- суть і практичне застосування електрофорезу в медико-біологічних дослідженнях;
- основні види очищення колоїдних розчинів;
вміти:
- проводити порівняльний аналіз дисперсних систем за їх фізико-хімічними властивостями;
- складати формулу міцели гідрофобного колоїдного розчину;
- вибирати метод очищення колоїдного розчину в залежності від виду домішок;
оволодіти навичками:
- лабораторного одержання колоїдних розчинів різними методами (гідролізу, подвійного обміну, заміни розчинника, пептизації);
- очищення колоїдних розчинів методом діалізу.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ ТА НАВИЧКИ,
НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Поняття про розчини.
2) Основні типи хімічних реакцій. Реакції обміну та гідролізу.
(Матеріал шкільної програми з хімії).
3) Поняття про гомогенні та гетерогенні системи.
4) Поняття про вибіркову адсорбцію.
(Матеріал попередніх занять з хімії).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
Дисперсні системи
 |  |
Гомогенні (істинні розчини) Гетерогенні

 Колоїдні розчини Грубодисперсні
Колоїдні розчини Грубодисперсні
 системи
системи
Одержання Будова колоїдних Властивості Очищення


 частинок
частинок


 Конден- Дисперга- Елек- Молеку- Оптичні саційні ційні тричні лярно- методи методи кінетичні
Конден- Дисперга- Елек- Молеку- Оптичні саційні ційні тричні лярно- методи методи кінетичні

Пептизація Будова ПЕШ Електрофорез та його застосу-
вання в медицині та біології
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Дисперсні системи та їх класифікація. | 1.1. Склад дисперсних систем. Дисперсна фаза та дисперсійне середовище. 1.2. Класифікація за агрегатним станом. 1.3. Класифікація за розміром частинок дисперсної фази: істинні розчини, колоїдні розчини, грубі дисперсії. |
| 2. Методи одержання колоїдних розчинів. | 2.1 Конденсаційні методи. 2.2 Диспергаційні методи. 2.3 Пептизація. |
| 3. Методи очищення колоїдних розчинів. | 3.1 Діаліз, електродіаліз, компенсаційний діаліз, вівідіаліз, принцип роботи апарату “штучна нирка”. 3.2. Ультрафільтрація. 3.3. Фільтрація. |
| 4. Будова міцели як структурної одиниці колоїдного розчину. | 4.1. Ядро міцели та вибіркова адсорбція йонів на ядрі. 4.2. Йони у структурі міцели. 4.3. Міцела як електронейтральна частинка колоїдного розчину. |
| 5. Властивості колоїдних розчинів. | 5.1. Молекулярно-кінетичні властивості: броунівський рух, дифузія, осмос. 5.2. Оптичні властивості. Ефект Тіндаля. 5.3. Електричні властивості. Будова ПЕШ колоїдної частинки. |
| 6. Електрофорез та його застосування в медико-біологічних дослідженнях. | 6.1. Електрокінетичні явища. 6.2. Електрокінетичний потенціал. 6.3. Електрофорез. Швидкість руху частинок при електрофорезі. 6.4. Застосування електрофорезу в медико-біологічних дослідженнях. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вибрати правильне визначення колоїдних розчинів:
а) дисперсні системи з різним дисперсійним середовищем;
б) дисперсні системи з розміром частинок дисперсної фази від 1 до 100 нм;
в) дисперсні системи з твердою дисперсною фазою;
г) дисперсні системи, що за розміром частинок дисперсної фази належать до гомогенних систем.
2) Вказати, які йони адсорбуються на поверхні ядра при утворенні міцели:
а) йони, що мають заряд, протилежний заряду ядра;
б) йони, концентрація яких у даному розчині максимальна;
в) йони, які не входять до складу ядра;
г) йони, які здатні добудовувати кристалічну гратку ядра.
3) Обгрунтувати формулу міцели золю, який утворюється при змішуванні 15,0 мл розчину з молярною концентрацією КСl 0,025 моль/дм3 та 85,0 мл розчину з молярною концентрацією АgNO3 0,005 моль/дм3.
4) Пояснити, які процеси лежать в основі пептизації:
а) в основі пептизації лежить гідроліз пептидних зв¢язків під дією дисперсійного середовища;
б) в основі пептизації лежить хімічне розчинення осаду внаслідок реакції з електролітом, який додається;
в) в основі пептизації лежить утворення колоїдної частинки внаслідок адсорбції йонів електроліту на частинках осаду;
г) в основі пептизації лежить утворення колоїдних частинок внаслідок адсорбції йонів, що є продуктами взаємодії частини осаду з електролітом.
5) Вказати, який метод краще застосувати для очищення колоїдного розчину від домішок глюкози:
а) фільтрація; б) діаліз; в) електродіаліз; г) вівідіаліз.
6) Вказати, на якому методі очистки колоїдних розчинів грунтується робота апарату “штучна нирка”.
а) ультрафільтрація; б) діаліз; в) електродіаліз; г) компенсаційний діаліз.
ПРАВИЛЬНІ ВІДПОВІДІ.
1) Правильна відповідь б).
Згідно з класифікацією дисперсних систем, колоїдні розчини – це мікрогетерогенні системи з розміром частинок дисперсної фази від 1 до 100 нм.
2) Правильна відповідь г).
На поверхні ядра міцели адсорбуються йони, які за правилами вибіркової адсорбції Панета-Фаянса здатні добудовувати кристалічну гратку ядра. Це – йони, які входять до складу ядра, або йони, ізоморфні тим, що утворюють кристалічну гратку, або йони, які містять ті ж самі елементи, що утворюють гратку ядра. Такі йони називаються потенціал-визначальними, вони обумовлюють знак заряду колоїдної частинки.
3) Спочатку визначимо, яка з речовин, що реагують, буде у надлишку:
AgNO3 + KCl = AgCl¯ + KNO3
Кількість речовини KCl: 0,015 дм3 · 0,025 моль/дм3 · 103 = 0,375 ммоль
Кількість речовини AgNO3: 0,085дм3 · 0,005моль/дм3 · 103=0,425 ммоль
Отже, у надлишку буде AgNO3. Це означає, що на поверхні ядра адсорбуватимуться катіони Ag+, які обумовлюють позитивний заряд гранули. Протиіонами будуть нітрат-іони.
Формула міцели матиме такий вигляд:
{[m AgCl] · n Ag+ · (n – x) NO3- }x+ · x NO3-
ядро адсорбційний шар йонів дифузний шар йонів
 г р а н у л а
г р а н у л а

 м і ц е л а
м і ц е л а
У цілому міцела електронейтральна.
4) Правильні відповіді в) і г).
Пептизація – це процес переходу свіжоутвореного осаду у колоїдний стан. Таке явище може відбуватися при додаванні до осаду електроліта, що містить йони, здатні адсорбуватися на частинках осаду за правилами вибіркової адсорбції (адсорбційна пептизація).
Пептизація відбувається і тоді, коли до осаду додають невелику кількість електроліту, який, реагуючи з поверхнею частинок осаду, утворює здатні до вибіркової адсорбції йони (хімічна пептизація).
Пептизація можлива також у певних випадках при промиванні осаду розчинником, якщо осад містив значну концентрацію одного з вихідниїх реагентів, бо не був ретельно відмитий.
5) Правильна відповідь б).
Оскільки домішки не є електролітами, краще застосувати простий діаліз.
6) Правильна відповідь г).
Апарат “штучна нирка” працює за принципом компенсаційного вівідіалізу (прижиттєвого). Кров хворого проходить по трубках з напівпроникними стінками, які омиваються фізіологічним розчином, що містить життєво необхідні речовини, які повинні залишатися в крові.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Одержання золю методом заміни розчинника.
Налити у пробірку 10 см3 дистильованої води і додати 1 см3 розчину сірки в етиловому спирті, одержаний тривалим настоюванням. Сірка розчиняється у спирті, утворюючи істинний розчин, і не розчиняється у воді, утворюючи колоїдну систему.
8.2. Одержання золю гідроксиду феруму (III) методом гідролізу.
Налити у конічну колбу 50 см3 дистильованої води і довести її до кипіння. Відібрати мірною пробіркою 5 см3 розчину FeCl3 (w = 5%) і поступово влити цей розчин у дистильовану воду, що кипить.
За умови високої температури відбувається повний гідроліз хлориду феруму (ІІІ):
FeCl3 + 3 H2O = Fe(OH)3 + 3 HCl
Продукти гідролізу частково реагують між собою:
Fe(OH)3 + HCl + FeOCl + 2 H2O
Хлорид оксоферуму (FeOCl), що утворився, стає стабілізатором колоїдних частинок.
Формула міцели золю Fe(OH)3 має такий вигляд:
{[m Fe(OH)3] · n FeO+ · (n – x) Cl-} x+ · x Cl-
Утворюється прозорий золь червоно-коричневого кольору.
8.3. Одержання золю берлінської лазурі за реакцією подвійного обміну.
Налити у пробірку 10 см3 розчину жовтої кров¢яної солі К4[Fe(CN)6]
(w = 0,10%) і додати 1-2 краплі розчину хлориду феруму (ІІІ) (w = 2%).
Утворюється блакитний прозорий колоїдний розчин берлінської лазурі Fe4[Fe(CN)6]3.
Написати рівняння реакції взаємодії жовтої кров¢яної солі з хлоридом феруму (ІІІ).
Написати й обгрунтувати формулу міцели добутого золю, враховуючи, що гранула має від¢ємний заряд.
8.4. Одержання золю гідроксиду феруму (ІІІ) методом пептизації.
Відміряти у колбу 50 см3 дистильованої води і додати 2 см3 розчину FeCl3 (w = 5%). Потім поступово додавати розчин аміаку (w = 5%) до одержання стійкого аміачного запаху. Внаслідок реакції утворюється бурий осад Fe(OH)3.
Після відстоювання осаду верхній шар рідини обережно злити, намагаючись не скаламутити розчин (декантація). До осаду додати приблизно 30 см3 дистильованої води, збовтати, дати відстоятися і знову злити розчин над осадом. Таке промивання осаду (декантацію) проробити тричі. Взяти дві невеликі порції промитого осаду (об¢ємом приблизно 1см3) і помістити у дві пробірки. У першу пробірку додати
10 см3 води, а у другу – 3 см3 води та 2 см3 розчину FeCl3 (w = 5%).
Написати рівняння реакції одержання осаду гідроксиду феруму. Скласти формулу міцели золю, що утворився внаслідок пептизації у другій пробірці.
8.5. Очищення дисперсії крохмалю методом діалізу.
Налити у целофановий мішечок невелику кількість розчину крохмалю з масовою часткою 1% і ще меншу кількість розчину сульфату натрію з масовою часткою 2%. Помістити мішечок у колбу з дистильованою водою так, щоб рівень води у колбі трохи перевищував рівень рідини у мішечку. Через 20 хвилин провести аналіз води, яка була у колбі, на наявність сульфат-іонів та молекул крохмалю. Для цього відлити приблизно по 2 см3 води у дві пробірки. У першу пробірку додати декілька крапель розчину Люголя (іод, розчинений у водному розчині іодиду калію) – якісна реакція на наявність у воді крохмалю. У другу пробірку додати 2-3 краплі розчину хлориду барію – якісна реакція на сульфат-іон.
Пояснити, про що свідчить негативна реакція у першій пробірці і позитивна реакція у другій. Зробити висновок про суть діалізу.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 603- 640.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я.
Биофизическая химия. -Київ: Вища школа, 1986.-С.187-222.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.
-М.: Высшая школа, 1975. –С. 132-152, 175-179.
ЗАНЯТТЯ № 9
1. ТЕМА. Коагуляція колоїдних розчинів.
2. ОБГРУНТУВАННЯ ТЕМИ. Усі біологічні рідини організму: кров, внутрішньоклітинна рідина, лімфа, сеча, спинномозкова рідина та ін. – є складними дисперсними системами. Для них дуже важливими факторами є сталість електролітного та білкового складу, рН. Зміна цих параметрів може призвести до початку коагуляційних процесів колоїдних фаз, зсідання еритроцитів та білків. Незначна зміна якісного складу електролітів в організмі може викликати коагуляцію колоїдних компонентів, тому що різні за зарядом йони мають різний поріг коагуляції. Коагуляційні процеси відбуваються і при зсіданні крові – комплексі ферментативних реакцій, що, з одного боку, забезпечують мінімальну втрату крові, а з другого – викликають утворення тромбів у кровоносних судинах. У багатьох випадках у клінічних лабораторіях виконують комплекс аналізів по дослідженню зсідання крові (коагуляційного гемостазу), а до складу загального клінічного аналізу крові входить ШОЕ (швидкість осідання еритроцитів). Майбутній лікар, безумовно, повинен уявляти, наскільки важливими є коагуляційні процеси для життєдіяльності організму, зберігання та консервації крові, застосування сучасних тромборезистентних матеріалів.
3. МЕТА. Сформувати уявлення про стійкість колоїдних систем, механізм коагуляції та фактори, що її викликають. Усвідомити важливість коагуляційних процесів для життєдіяльності організму та медичної практики.
Студент повинен знати:
- фактори стійкості колоїдних систем;
- причини та механізм коагуляції колоїдів;
- особливості коагуляції золей електролітами, правило Шульце-Гарді;
- роль коагуляції у біологічних системах;
- супутні коагуляційні процеси (чергування зон коагуляції, звикання золей, взаємна коагуляція); вміти:
- розраховувати поріг коагуляції електролітів;
- оцінювати коагуляційну здатність електролітів за правилом Шульце-Гарді;
оволодіти навичками:
- проведення коагуляції колоїдних систем електролітами.
4. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ,
НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ.
1) Характеристика йонів (заряд, радіус, гідратна оболонка).
(Матеріал шкільної програми з хімії).
2) Будова міцели золя.
3) Поверхнева енергія межі поділу фаз у гетерогенній системі.
(Матеріал попередніх занять).
5. ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
Стійкість колоїдних систем

Коагуляція і фактори, що її викликають
 |  |  |
Теорія і механізм Коагуляція Коагуляція в біологічних
коагуляції електролітами системах
 |  |  |
Супутні Правило Коагуляція
коагуляційні Шульце-Гарді сумішами
 процеси електролітів
процеси електролітів
Визначення порогів коагуляції золю електролітами
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ
(самостійна позааудиторна робота студентів).
| Зміст і послідовність дій | Вказівки до навчальних дій |
| 1. Стійкість колоїдних розчинів. | 1.1. Кінетична (седиментаційна) стійкість. 1.2. Агрегативна стійкість. |
| 2. Коагуляція колоїдів. | 2.1. Фактори, що викликають коагуляцію. 2.2. Кінетика коагуляції. 2.3. Теорія Дерягіна-Ландау-Фервея-Овербека. 2.4. Коагуляція у біологічних системах. |
| 3. Коагуляція електролітами. | 3.1. Поняття про концентраційну і нейтралізаційну коагуляцію електролітами. 3.2. Поріг коагуляції та коагулююча здатність електролітів. 3.3. Залежність порогу коагуляції та коагулюючої здатності від заряду та радіусу гідратованого йона. Ліотропні ряди катіонів та аніонів. 3.4. Коагуляція сумішами електролітів: адитивність, синергізм та антагонізм йонів при коагуляції. 3.5. Супутні коагуляційні явища: чергування зон коагуляції, звикання золей, взаємна коагуляція. |
| 4. Визначення порогів коагуляції золю гідроксиду феруму (ІІІ) електролітами з різними зарядами коагулюючого йона. |
7. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів).
1) Вказати фактори, що зумовлюють стійкість колоїдних розчинів:
1 – знак заряду частинки; 2 – величина заряду частинки;
3 – товщина дифузного шару; 4 – вид йонів у дифузному шарі;
5 – броунівський рух колоїдних частинок;
6 - величина електрокінетичного потенціалу.
а) 1, 2, 3, 6; б) 2, 3, 5, 6; в) 1, 2, 4, 5; г) 1, 3, 4, 5.
2) Вибрати фактори, що викликають коагуляцію золю:
1 – зміна температури; 2 – додавання розчинника;
3 – зміна тиску; 4 – додавання електроліту;
5 – додавання водовіднімаючих засобів.
а) 1, 2, 3; б) 1, 3, 4; в) 1, 4, 5; г) 2, 3, 5.
3) Вибрати фактори, від яких залежить поріг коагуляції та коагулююча здатність йонів:
а) концентрація йона; б) ступінь гідратації йона;
в) заряд йона; г) температура.
4) Вибрати електроліт, для якого поріг коагуляції золю з від¢ємним зарядом частинок буде мінімальним:
а) Na2CO3; б) K3PO4; в) CaCl2; г) Al(NO3)3.
5) Вказати, до якого електрода будуть рухатися частинки золю при електрофорезі, якщо при дослідженні коагуляції цього золю одержані
такі значення порогів коагуляції для електролітів (ммоль/дм3):
K3PO4 – 0,02; MgSO4 – 1,50; FeCl3 – 201,3.
а) до катода; б) частинки не рухаються;
в) до анода; г) визначити неможливо.
6) Вибрати правильну характеристику явища антагонізму йонів при коагуляції:
а) неможливість йонів існувати одночасно в одному розчині внаслідок реакції між ними;
б) зниження розчинності йонів при спільній присутності в розчині;
в) зниження порогів коагуляції йонів при спільній коагуляції;
г) зниження коагулюючої здатності йонів при спільній коагуляції.
ПРАВИЛЬНІ ВІДПОВІДІ.
1) Правильна відповідь б).
Стійкість колоїдних розчинів обумовлюють фактори агрегативної стійкості: величина заряду, товщина дифузного шару (гідратної оболонки), величина дзета-потенціалу, і фактор кінетичної стійкості – броунівський рух частинок. Від знаку заряду частинки і природи йонів дифузного шару стійкість колоїдних розчинів не залежить.
2) Правильна відповідь в).
Зміна температури, додавання електроліту та водовіднімаючих засобів, а також сильні механічні втручання можуть змінити величини факторів стійкості колоїдних систем, сприяти коагуляції. Зміна тиску майже не впливає на стан рідких систем, а додавання розчинника, у переважній більшості випадків, підвищує стабільність колоїдних систем, тому що при цьому зменшується концентрація дисперсної фази.
3) Правильні відповіді б) і в).
Поріг коагуляції визначається кількістю еквівалентів електроліту, яка викликає коагуляцію 1 л золю (ммоль/л), а коагулююча здатність є величиною, оберненою порогу коагуляції. Отже, обидва показники не залежать від концентрації йонів у розчині, тому що при коагуляції буде змінюватися об¢єм цього розчину. Сила йона, як коагулянта, визначається зарядом йона та ступенем гідратації (радіусом гідратованого йона). Причому, чим більший заряд і менший ступінь гідратації (радіус гідратованого йона), тим менший поріг коагуляції і більша коагулююча здатність йона. Температура однаковою мірою впливає на коагуляційну здатність всіх йонів, тобто на коагуляцію в цілому.
4) Правильна відповідь г).
Оскільки частинки золю мають від¢ємний заряд, коагуляцію цього золю викликатимуть катіони. Згідно з правилом Шульце-Гарді, найменше значення порогу коагуляції матиме катіон з максимальним зарядом, тобто катіон алюмінію. Отже, для нітрату алюмінію поріг коагуляції буде найменшим.
5) Правильна відповідь а).
Зробимо припущення, що коагуляцію викликають катіони, тоді максимальний поріг коагуляції мав би фосфат калію (заряд катіона +1), а мінімальний поріг коагуляції – хлорид феруму (ІІІ) (заряд катіона +3). Це припущення не відповідає одержаним даним і повинне бути відкинуте. Проаналізуємо припущення, що коагуляцію викликають аніони, тоді фосфат калію (заряд аніона –3) повинен мати найменше значення порогу коагуляції, а хлорид феруму (ІІІ) (заряд аніона –1) – найбільше. Це припущення підтверджується результатами дослідження.
Отже, коагуляцію золю викликають аніони, а заряд частинок золю позитивний. При електрофорезі ці частинки рухатимуться до катода (негативно зарядженого електрода).
6) Правильна відповідь г).
Явище антагонізму йонів при коагуляції проявляється в тому, що при спільній коагуляції цих йонів поріг коагуляції йона буде більшим, ніж при індивідуальній дії, а, відповідно, коагулююча здатність – меншою. Однозначного теоретичного обгрунтування такого явища немає.
8. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ.
8.1. Приготування розведених розчинів електролітів.
Підготувати три серії пробірок по 5 штук у кожній, у яких буде досліджуватися коагулююча дія електролітів:
І серія – розчин з молярною концентрацією еквівалента КСl 2,0 моль/л;
ІІ серія – розчин з молярною концентрацією еквівалента К2СrO4 0,1 моль/л;
ІІІ серія – розчин з молярною концентрацією еквівалента К4[Fe(CN)6] 0,01 моль/л.
Приготувати розведені розчини електролітів.
Для цього налити у першу пробірку 10 см3 розчину електроліту, а у чотири інші пробірки серії – по 9 см3 дистильованої води. Перенести 1 см3 розчину з першої пробірки у другу, після перемішування з другої пробірки 1 см3 розчину перенести у третю, з третьої – у четверту, потім з четвертої – у п¢яту. З останньої пробірки, після перемішування, 1 см3 розчину вилити геть. Таким чином, одержані п¢ять розчинів електроліту, концентрація яких поступово зменшується у 10 разів.
8.2. Проведення коагуляції.
Додати до всїх розчинів електролітів по 1,0 см3 золю гідроксиду феруму (ІІІ), перемішати. Через 5-10 хвилин відмітити пробірки, в яких відбулася коагуляція – розчини стали каламутними, або утворився осад.
Визначити найменшу концентрацію розчину електроліту, що викликала коагуляцію.
8.3. Розрахунок порогу коагуляції електроліту.
Визначити величину порогу коагуляції для кожного електроліту за формулою:
Спор. = 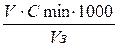
 , ммоль/л;
, ммоль/л;
де: Спор . –поріг коагуляції, ммоль/л;
V - об¢єм розчину електроліту, см3;
Сmin - мінімальна молярна концентрація еквівалента електроліту, моль/дм3;
V з - об¢єм золю, см3.
8.4. Визначення залежності між величиною порогу коагуляції та зарядом йона.
Результати дослідження та розрахунків занести у таблицю.
| № серії | Електроліт | Вихідна кон-центрація, моль/л | Пробірки, де відбулася коагуляція | Сmin, моль/л | Спор., ммоль/л | Заряд коа-гулюючого йона |
| І | KCl | 2,0 | ||||
| ІІ | K2CrO4 | 0,1 | ||||
| ІІІ | K4[Fe(CN)6] | 0,01 |
Зробити висновок про вид коагулюючого йона (аніон чи катіон) та про залежність величини порогу коагуляції від заряду йона, що викликає коагуляцію.
8.5. Оформлення протоколу лабораторної роботи.
Записати у зошит необхідні розрахунки, заповнити таблицю та записати висновок про вид коагулюючого йона (аніон чи катіон) та про залежність величини порогу коагуляції від заряду йона, що викликає коагуляцію.
9. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 641-671.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я.
Биофизическая химия. -Київ: Вища школа, 1986.-С.222-233.
4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия.
-М.: Высшая школа, 1975. –С. 132-152, 175-179.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1422; Нарушение авторских прав?; Мы поможем в написании вашей работы!