
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Питання для контролю знань. 1. Написати формули для розрахунку добутків розчинності сполук:
|
|
|
|
1. Написати формули для розрахунку добутків розчинності сполук:
фосфат барію, оксалат кальцію, гідроксид Купруму (ІІ).
2. Пояснити, як вплине на розчинність фосфату кальцію додавання
до нього розчину фосфату натрію.
3. Розрахувати, чи буде утворюватися осад Аg3РО4 (ДР = 1,8 · 10-18), якщо злити 100 мл розчину АgNOз з молярною концентрацією
5 · 10-4 моль/л і 100 мл розчину Nа3РО4 з молярною концентрацією 6 · 10-3 моль/л.
4. Розрахувати концентрацію катіонів барію у насиченому розчині ВаSО4, якщо добуток розчинності ВаSО4дорівнює 1,0 · 10-10.
7. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006,
с. 177-184.
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
2. Селезнев К.А. Аналитическая химия. М., Химия, 1973, с. 35 - 41.
3. ЛенскийА.С. Введение в бионеорганическую й биофизическую химию.
М., Высшая школа, 1989, с. 160 - 165.
1. TЕМA. Розчини. Розрахунки в титриметричному аналізі.
2. МЕТА. Закріпити знання про величини, що характеризують кількісний склад розчинів та знання теоретичних основ титриметричного аналізу.
Студент повинен знати:
- величини, що характеризують кількісний склад розчинів;
- формули для визначення масової частки, молярної концентрації, молярної концентрації еквівалента;
- формули для визначення кількості речовини, кількості речовини еквівалента, молярної маси еквівалента, фактора еквівалентності;
- формули для проведення розрахунків у титриметричному аналізі;
вміти:
- розраховувати концентрацію розчинів;
- розраховувати масу і кількість розчиненої речовини в розчині;
- переводити одну форму вираження концентрації в іншу;
- проводити розрахунки за формулами титриметричного аналізу.
3. ОРІЄНТОВНА КАРТКА ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
| Зміст і послідовність дій | Вказівки до навчальних дій | |
| 1. Види концентрації розчинів. | 1.1. Масова, об’ємна та молярна частки. 1.2. Молярна концентрація. 1.3. Молярна концентрація еквівалента (деци-, санти-, мілі-, та мікромолі). | |
| 2. Розрахунки в об’ємному аналізі. | 2.1. Основна формула об’ємного аналізу. 2.2. Визначення концентрації речовини в досліджуваному розчині. 2.3. Визначення чистоти речовини за допомогою об’ємного аналізу. |
4. ЗАДАЧІ ДЛЯ САМОСТІЙНОГО РОЗВ’ЯЗАННЯ
Задача 1.
Глутамінова кислота застосовується при лікуванні захворювань ЦНС у вигляді розчинів з масовою часткою 1% і густиною 1,12 г/см3. Розчинником є розчин з масовою часткою глюкози 25%. Розрахувати масу глутамінової кислоти, що необхідна для приготування 50 см3 розчину.
РОЗВ’ЯЗАННЯ
1) Знаходимо масу розчину глутамінової кислоти:
m(р-ну) = ρ ∙ V = 1,12 г/см3 ∙ 50 см3 = 56 г
2) Знаходимо масу глутамінової кислоти в цьому розчині:
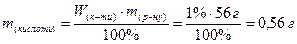
Задача 2.
При запаленнях шкіри і слизових оболонок використовують розчин ацетату алюмінію, який одержують розчиненням 8,7 г солі в 100 мл води. Визначити молярну концентрацію ацетату алюмінію у такому розчині, якщо густина розчину 1,05 г/см3.
РОЗВ’ЯЗАННЯ
1) Розраховуємо кількість речовини ацетату алюмінію:
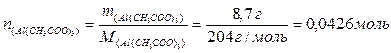
2) Визначаємо масу розчину, враховуючи, що ρ(Н2О) = 1 г/см3:
m(розчину) = m(Аl(СНзСОО)з) + m(води) = 8,7 г + 100 г = 108,7 г
3) Знаходимо об’єм розчину:

4) Знаходимо молярну концентрацію солі:

Задача 3.
При проведенні якісної проби Обермейєра в біохімічному аналізі застосовують реактив, який є розчином з масовою часткою хлориду заліза (ІІІ) 0,335% у концентрованій соляній кислоті. Густина такого розчину 1,2 г/см3. Визначити молярну концентрацію еквівалента хлориду заліза (ІІІ) у цьому розчині.
РОЗВ’ЯЗАННЯ
1) Припустимо, що об’єм розчину дорівнює 1 л: V(розчину) = 1л = 1000см3
2) Визначаємо масу розчину такого об’єму:
m(розчину) = V(poзчинy)∙ ρ = 1000 см3 · 1,2 г/см3 = 1200 г
3) Знаходимо масу хлориду заліза (ІІІ):

4) Знаходимо молярну масу еквівалента хлориду заліза (ІІІ):

5) Знаходимо кількість речовини еквівалента хлориду заліза (ІІІ) в 1 л розчину, тобто молярну концентрацію еквівалента:
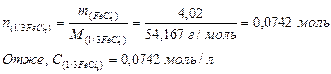
Задача 4.
1,14 г реактивної щавелевої кислоти Н2С2О4 ∙ 2Н2О розчинили у воді і приготували 200 мл розчину. На титрування 25,00 мл такого розчину було витрачено 20,00 мл розчину з молярною концентрацією еквівалента NaОН 0,1 моль/л. Визначити масову частку чистої щавелевої кислоти у наважці.
РОЗВ’ЯЗАННЯ
1) За основним рівнянням титрування знаходимо молярну концентрацію еквівалента щавелевої кислоти у розчині:
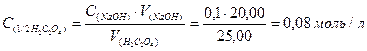
2) Знаходимо масу дигідрату щавелевої кислоти в одному літрі розчину;

М 
 -молярна маса еквівалента дигідрату щавелевої кислоти, г/моль;
-молярна маса еквівалента дигідрату щавелевої кислоти, г/моль;
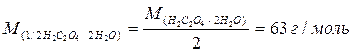
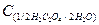 - молярна концентрація еквівалента дигідрату
- молярна концентрація еквівалента дигідрату
щавелевої кислоти, моль/л;

3) Знаходимо мacy дигідрату щавелевої кислоти у 200 мл (0,2л)приготовленого розчину:

4) Знаходимо масову частку чистої щавелевої кислоти (дигідрату) у наважці:
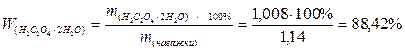
5. ЛІТЕРАТУРА.
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006,
2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008.
3. Садовничая Л.Л., Хухрянский В.Г., Биофизическая химия. К: Вища школа, 1986.
4. Ленский А.С. Введение в бионеорганическую химию. М: Высшая школа, 1989.
5. Бабков А.В. и др. Практикум по общей химии с элементами количественного анализа. М: Высшая школа, 1978.
1. ТЕМА. Окисно-відновне титрування (оксидиметрія).
Метод перманганатометрії.
2. ОБҐРУНТУВАННЯ ТЕМИ. Окисно-відновні реакції є одним з основних видів взаємодії в живому організмі. Реакції окиснення-відновлення лежать в основі ряду методів кількісного аналізу, які об’єднуються під загальною назвою оксидиметрії. Цими методами визначають вміст окисників і відновників у розчинах, біологічних рідинах, воді. Одним з методів оксидиметрії є перманганатометрія (робочий розчин - перманганат калію). Методом перманганатометрії можна визначати вміст сечової кислоти у сечі та крові, іонів кальцію, окислювального фермента каталази. Цей метод використовується у санітарно-гігієнічному аналізі при дослідженні питної води та стічних вод. Розчини перманганату калію застосовуються також як дезинфікуючі засоби, компоненти відбілюючих рецептур у стоматології.
3. МЕТА. Сформувати уявлення про можливості застосування окисно-відновних реакцій у кількісному аналізі та засвоїти принципи перманганатометричного титрування.
Студент повинен знати:
- основні положення теорії окисно-відновної взаємодії;
- суть методів оксидиметрії, зокрема перманганатометрії;
- особливості дії перманганату калію як окисника в різних середовищах;
- особливості перебігу окисно-відновних реакцій в організмі;
вміти:
- складати рівняння окисно-відновних реакцій;
- проводити перманганатометричне титрування;
- виконувати розрахунки в перманганатометричному аналізі.
4. ОРІЄНТОВНА КАРТКА ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
| Зміст і послідовність дій | Вказівки до навчальних дій | |
| 1. Окисно-відновна взаємодія | 1.1. Теорія окисно-відновних реакцій. 1.2. Класифікація окисно-відновних реакцій (міжмолекулярні, внутрішньомолекулярні, диспропорціонування). 1.3. Складання рівнянь окисно-відновних реакцій. | |
| 2. Окисно-відновні реакції в живому організмі. | ||
| 3. Оксидиметрія. | ||
| 4. Перманганатометрія. | 4.1. Суть методу перманганатометрії. Робочий розчин. Індикатори методу. | |
| 4.2. Окислювальна дія перманганату калію в залежності від реакції середовища. 4.3. Особливості титрування в перманганатометрії. Автокаталіз. | ||
| 5. Визначення масової частки сульфату Феруму (ІІ) у тех-нічному купоросі. | 5.1. Техніка титрування. 5.2. Розрахунок масової частки за даними титрування. | |
5. ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
1) Вказати, які з наведених речовин мають бути тільки окисниками
(за станом хрому):
а) К2Сr2О7 б) Сr2Оз в) Na2CrO4 г) NaCrO2
2) У якій з наведених схем відбувається окиснення елемента?
а) NО3- → NНз; б) СО → CO2; в) NO2 → NO; г) CO2 → СОз2-.
3) Скласти повне молекулярне рівняння окиснення сульфату
Мангану (ІІ) перманганатом калію у нейтральному середовищі,
якщо іоннасхемареакції має вигляд:
Мn2+ + МnО4- + H2O = MnO2 +...
Знайти повну суму коефіцієнтів у молекулярному рівнянні.
а) 21 б) 32 в) 10г) 15
4) Визначити молярну масу еквівалента перманганату калію у перманганатометричному титруванні.
а) 31,61 б) 52,68 в) 79,02 г) 158,04
5) Вказати особливість окиcно-відновних реакцій у живих організмах.
ПРАВИЛЬНІ ВІДПОВІДІ
1) Правильні відповіді а) і в).
У сполуках К2Сr2О7 і Na2CrO4 ступінь окиснення хрому максимальна (+6), а в інших сполуках +3. Сполука з максимальним значенням ступеня окиснення може бути тільки окисником
2) Правильна відповідь б).
Окиснення супроводжується збільшенням ступеня окиснення.
а) N+5О3-→ N-3H3 б) С+2О → C+4О2 в)N+4O2 → N+2O
г) С+4О2 → С+4О32-
3) Правильна відповідьг).
Скористаємося іонно-електронним методом складання окисно-відновних рівнянь. Оскільки реакція відбувається в нейтральному середовищі, у ліву частину напіврівнянь входить тільки вода, а у праву частину - іони Н+ або іони ОН-. Напіврівняння окиснення:

 Мn2+ + 2 H2O -2е- → MnO2 + 4H+ 3
Мn2+ + 2 H2O -2е- → MnO2 + 4H+ 3
Напіврівняння відновлення: 6
МnО4- + 2 H2O + Зе- → MnO2 + 4 ОН- 2
Складемо обидва напіврівняння з урахуванням рівності кількості відданих і прийнятих електронів:
3 Мn2+ + 2 МnО4- + 10 Н2О = 5 MnO2 + 12 H+ + 8 ОН-
Враховуючи, що 8 Н+ + 8 ОН- = 8 Н2О, маємо:
3 Мn2+ + 2 MnO4- + 10 H2O = 5 MnO2 + 8 H2O + 4 Н+
Виключаючи по 8 Н2Оз лівої і правої частин:
3 Мn2+ + 2 MnО4- + 2 Н2О = 5 MnO2 + 4 Н+
Одержали повне іонне рівняння, а повне молекулярне рівняння буде мати вигляд (додаємо в обидві частини 3 SО42- + 2 К+):
3 MnSO4 + 2 КМnO4 + 2 H2O = 5 MnO2 + К2SО4 + 2 H2SO4
Отже, сума всіх стехіометричних коефіцієнтів дорівнюватиме 15.
4) Правильна відповідь а).
Перманганатометричне титрування проводять у кислому середовищі, що відповідає максимальній окислювальній здатності перманганату калію, а також легкості фіксації кінця титрування. Відновлення перманганату в кислому середовищі відповідає рівнянню:
МnО4- + 8 Н+ + 5е- → Мn2+ + 4 H2O
Молярна маса еквівалента перманганату калію буде обчислюватися за формулою:
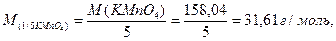
оскільки кількість прийнятих одним моль КМnО4 електронів буде п’ять.
5) У живих організмах основним відновником є Гідроген субстратів, а окисником - кисень. Особливістю окиснення Гідрогену субстратів є багатостадійність процесу, а також те, що енергія хімічної реакції виділяється переважно не у вигляді тепла, а у вигляді хімічної енергії зв'язків макроергічних сполук (АТФ, АДФ), що при цьому синтезуються.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!