
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость смесей
|
|
|
|
Задачи
28. Найти средние удельные изохорную и изобарную теплоемкости кислорода в интервале температур 1600 ¸ 1200 °С. Ответ:  = 0,778 кДж/(кг×К),
= 0,778 кДж/(кг×К), 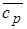 = 1,0651 кДж/(кг×К).
= 1,0651 кДж/(кг×К).
29. Найти среднюю молярную изохорную теплоемкость кислорода при нагревании его от 0 до 1000°С. Ответ: 23,02 кДж/(моль×К).
30. В помещении размером 6х5х3 м температура воздуха 27°С при давлении 101 кПа. Найти, какое количество теплоты нужно отвести от этого воздуха, чтобы понизить его температуру до 17°С при том же давлении. Средняя удельная изобарная теплоемкость воздуха равна 1,004 кДж/(кг×К). Массу воздуха в помещении условно принять постоянной. Ответ: -1,06 МДж.
Пример 15. Температура смеси, состоящей из азота массой 3 кг и кислорода массой 2 кг, в результате подвода к ней теплоты при постоянном объеме повышается от 100 до 1100°С. Найти количество подведенной теплоты.
Решение. Искомое количество теплоты найдем из уравнения:
Q12 = 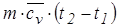 .
.
Среднюю удельную изохорную теплоемкость найдем по уравнению:
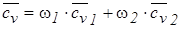 ,
,
где w1 и w2 – массовые доли компонент смеси, равные, соответственно, 3/5 и 2/5;  1,
1,  2 – теплоемкости компонент смеси, которые определяются по таблицам прил. для средней температуры 600°С.
2 – теплоемкости компонент смеси, которые определяются по таблицам прил. для средней температуры 600°С.
Таким образом,  = 0,6×843+0,4×809=829,4 Дж/(кг×К).
= 0,6×843+0,4×809=829,4 Дж/(кг×К).
Найдем подведенную теплоту:
Q12 = 5×829,4×1000 = 4147 кДж.
Пример 16. Состав продуктов сгорания бензина в цилиндре двигателя внутреннего сгорания в молях следующий: углекислого газа – 71,25, кислорода – 21,5, азота – 488,3, паров воды – 72,5 при температуре этих газов 800°С. Определить долю тепловых потерь с уходящими газами, если теплота сгорания бензина 43950 кДж.
Решение. Найдем сначала теплоту Q1 уходящих (выхлопных) газов. Полагая, что сгорание происходит при постоянном давлении, запишем уравнение для количества теплоты в виде
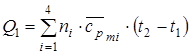 ,
,
где ni –количество вещества i – го компонента смеси,  - средняя молярная изобарная теплоемкость i-го компонента смеси.
- средняя молярная изобарная теплоемкость i-го компонента смеси.
Для определения необходимо знать молярные массы компонент и найти по таблицам прил. изобарные теплоемкости газов для средней температуры смеси, равной 400°С. Тогда
для CO2:  = 0,9868 103×0,044 = 43,42 Дж/(моль× К),
= 0,9868 103×0,044 = 43,42 Дж/(моль× К),
для О2: 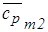 = 0,9651103×0,032 = 30,88 Дж/(моль× К),
= 0,9651103×0,032 = 30,88 Дж/(моль× К),
для N2: 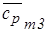 = 1,0567 103×0,028 = 29,59 Дж/(моль× К),
= 1,0567 103×0,028 = 29,59 Дж/(моль× К),
для H2O:  = 1,9477 103 ×0,018 = 35,06 Дж/(моль× К).
= 1,9477 103 ×0,018 = 35,06 Дж/(моль× К).
Теперь можем найти количество теплоты:
Q1 = (71,25×43,42 +21,5×30,88+488,3×29,59 +72,5×35,06)×(800-0) = 16,6 МДж.
Следовательно, доля тепловых потерь составляет
Q1/Q = 16598/43950 = 0,378 или 37,8%.
Задача
31.Состав отработавших газов двигателя внутреннего сгорания в молях следующий: nCO2 = 74,8; nH2O = 68; nO2 = 119; nN2 = 853. Найти количество теплоты, выделяемой при понижении их температуры от 380°С до 20°С при постоянном давлении. Ответ: -12,17 МДж.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 2082; Нарушение авторских прав?; Мы поможем в написании вашей работы!