
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамический процесс и его энергетические характеристики 1 страница
|
|
|
|
Термодинамический процесс – это всякое изменение, происходящее в термодинамической системе и связанное с изменением хотя бы одного из её параметров состояния.
Различают такие процессы.
Обратимыми называются процессы, которые могут быть проведены в прямом и обратном направлениях таким образом, что все тела, участвующие в процессе, проходят через одни и те же промежуточные равновесные состояния, но в обратной последовательности.
Необратимыми называются процессы, не отвечающие поставленным условиям. Все неравновесные процессы необратимы.
Квазистатические называются процессы, происходящих очень медленно, с малыми отклонениями промежуточных параметров.

Процессы расширения в р, v-диаграмме:
1 — изохора; 2 — изобара; 3 изотерма; 4 — адиабата
Частные случаи термодинамического процесса:
Адиабатический процесс - термодинамический процесс, при котором нет теплообмена между системой, совершающей процесс, и окружающей средой.
Изобарный процесс - термодинамический процесс, протекающий при постоянном давлении.
Изотермный процесс - термодинамический процесс, протекающий при постоянной температуре.
Изохорный процесс - термодинамический процесс, протекающий при пост. уд. объёме системы.
Изоэнтальпический процесс - термодинамический процесс, протекающий при пост. удельной энтальпии.
Изоэнтропийный процесс- термодинамический процесс, протекающий при пост. удельной энтропии.
11.Деформационная, полезная внешняя и техническая работа, их взаимосвязь.
Деформационная работа - работа совершаемая системой над окружающей средой
 - элементарная деформационная работа.
- элементарная деформационная работа.
 - работа на конечном изменении обьема.
- работа на конечном изменении обьема.
Работа L зависит от пути перехода системы из состояния 1 в состояние 2 то есть является функцией процесса а не состояния. Деформационную работу подразделяют на работу расширения и работу сжатия, работа расширения имеет положительный знак, а работа сжатия отрицательный.

Техническая работа- работа совершаемая потоком над введенным в систему техническим механизмом.
Связь: если кинетическая энергия равна нулю:
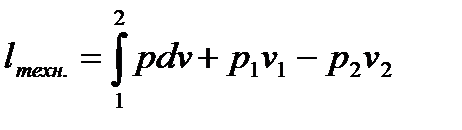
12. Теплота и теплоемкость в изопараметрических процессах.
Изохорный процесс: при изохорном процессе полученная телом теплота идет на изменение внутренней энергии тела.  . Так как теплоемкость процесса равна:
. Так как теплоемкость процесса равна: 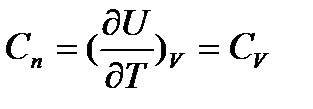 , тогда теплота процесса будет равна:
, тогда теплота процесса будет равна: 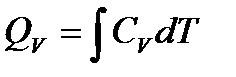 .
.
Изобарный процесс: при изобарическом процессе полученное телом тепло равно изменению энтальпии процесса: 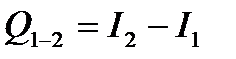 , так как теплоемкость процесса равна:
, так как теплоемкость процесса равна: 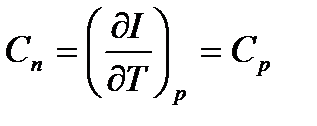 , то теплоту процесса можно представить в виде:
, то теплоту процесса можно представить в виде: 
Изотермический процесс: количество тепла полученное системой равно: 
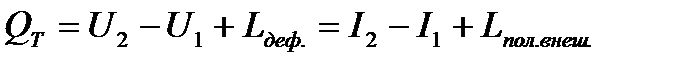
Теплота процесса в интегральной форме:

Теплоемкость идеального газа - это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло. Поскольку изменения температуры при изотермическом процессе нет, то теплоёмкость стремиться к бесконечности.
Адиабатический процесс: 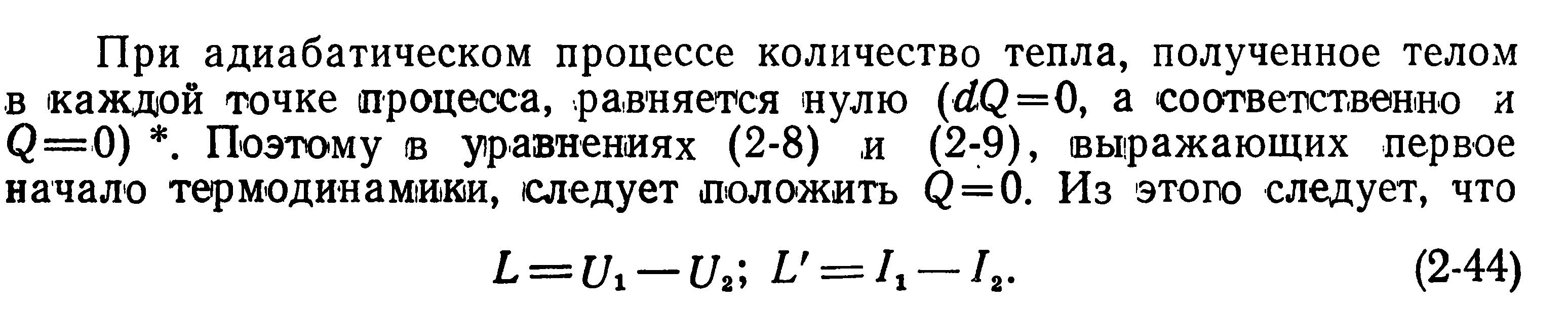
Теплоемкости адиабатного процесса:

13. Сущность постулатов и основных законов ТД
постулат о существовании термодинамического равновесия— утверждает, что макроскопическая система, находящаяся в неизменных внешних условиях, всегда приходит самопроизвольно в состояние термодинамического равновесия, которое характеризуется тем, что:
1.прекращаются всякие макроскопические изменения в системе; каждый параметр, характеризующий макроскопическое свойство системы, имеет постоянное во времени значение;
2.система, перешедшая в состояние термодинамического равновесия, сколь угодно долго остаётся в этом состоянии; для нарушения равновесия необходимы внешние воздействия.
0 закон ТД (Принцип термического равновесия) (первый постулат): если две системы, обозначенные как А и В, находятся порознь в термическом равновесии с третьей системой С, то они находятся в термическом равновесии друг с другом.
второй постулат термодинамики: все равновесные внутренние параметры являются функциями внешних параметров и температуры.
Третий постулат (исходном положении) термодинамики: при заданных внешних параметрах энергия системы является монотонной функцией температуры.
1 закон ТД: Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
Первое начало термодинамики:
при изобарном процессе 
при изохорном процессе 
при изотермическом процессе 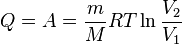
Здесь m — масса газа, M— молярная масса газа, Cv— молярная теплоёмкость припостоянном объёме, p, V, T — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
2 закон ТД: Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему.
3 закон ТД: Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система.  где х— любой термодинамический параметр.
где х— любой термодинамический параметр.
14. Сущность, формулировки и общее аналитическое выражение первого закона термодинамики
1.Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами. ΔU = Q – A.
2.Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
3. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0). В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением A = p (V2 – V1) = p ΔV.
Первый закон термодинамики для изобарного процесса дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV.
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением Q = A.
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Адиабатический процесс
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид A = –ΔU, т. е. газ совершает работу за счет убыли его внутренней энергии.
15. Выражение первого закона термодинамики для закрытой ТДС. Закрытая система обменивается с окружающей средой энергией, но не обменивается веществом.
выражение первого закона термодинамики для замкнутой системы будет иметь вид:  .
.
где U2 - U1 - изменение внутренней энергии системы;
Q - количество теплоты, полученное телом (системой) от внешней среды;
L' - работа изменения объема, совершаемая телом (системой) над внешней средой.
Штрих указывает на то, что это работа изменения объема действительного необратимого процесса.
16. Выражение первого закона термодинамики для проточной ТДС
Проточная система является частным случаем открытой ТС, когда
вещество на одном участке границы ТС входит в систему, а на другом участке – выходит из ТС.
Уравнение 1-го закона термодинамики для конечного процесса в проточной ТС в виде:  где
где
 - сумма величин механической природы,
- сумма величин механической природы,
называемой располагаемой работой.
17. Формы записи первого закона ТД. Работа проталкивания.
Первый закон термодинамики: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Q = ΔU + A.
В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях.
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением A = p (V2 – V1) = p ΔV.
Первый закон термодинамики для изобарного процесса дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением Q = A
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид A = –ΔU, т. е. газ совершает работу за счет убыли его внутренней энергии.
Работа проталкивания - каждый элемент объема вытесняет равный ему объем вещества.
Работа проталкивания измеряет затраты энергии на перемещение заданного объема газа (v) под влиянием перепада давления. Работа проталкивания в покоящемся газе равна нулю.
Работа проталкивания отражает взаимодействие открытой термодинамической системы с силами давления окружающей среды.
Работу проталкивания можно представить в виде суммы работы изменения объема pdv и работы сил давления по перемещению среды vdp:
d (pv) pdv - - vdp.
Работа проталкивания может быть рассчитана по параметрам р и v начального и конечного состояний, независимо от того, какого вида процесс осуществляется между этими состояниями.
L=p*A*Δx=pV.
А- работа, р- давление, V- объем.
18. Тепловая машина. Прямой и обратный цикл.
Тепловой машиной называется любое периодически действующее устройство, которое производит работу за счет получаемой извне теплоты. Прямым круговым процессом (циклом тепловой машины) называется цикл, в котором полученная извне теплота превращается в полезную работу. Обратным круговым процессом (циклом холодильной машины) называется цикл, в котором полученная извне работа затрачивается на перенос теплоты от менее нагретых тел к более нагретым телам.
19. Цикл Карно и его термический КПД.
В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником.
коэффициент полезного действия тепловой машины Карно равен
 (Н – нагревателя, Х – холодильника)
(Н – нагревателя, Х – холодильника)
20. Энтропия и ее свойства
Энтропия - функция, характеризующая направление протекания самопроизвольных процессов в замкнутой термодинамической системе.
С макроскопической точки зрения энтропия выражает способность энергии к превращениям: чем больше энтропия системы, тем меньше заключенная в ней энергия способна к превращениям. С помощью понятия энтропия формулируется один из основных физических законов - закон возрастания энтропии, или второе начало термодинамики, определяющее направление энергетических превращений: в замкнутой системе энтропия не может убывать.
dQ/T = dS
Единица энтропии - джоуль на кельвин (Дж/К).
Свойства: аддитивность, неотрицательность, равенство нулю при абсолютном нуле температуры.
энтропия является величиной аддитивной: энтропия сложной системы равна сумме энтропий ее частей.
закон возрастания энтропии: в замкнутыхсистемах энтропия никогда не убывает - она или увеличивается, или, в предельном случае, постоянн а.
20. Энтропия и ее свойства
Энтропия - термодинамическая функция состояния системы определяющая меру рассеивания энергии.
Свойства энтропии:
1)Энтропия есть параметр состояния, характеризующий свойства макроскопической системы в условиях равновесия.
2)Энтропия системы может изменяться, но переходить из тела в тело она не в состоянии. Переходит только теплота.

21. Сущьность и основные формулировки 2 закона термодинамики. Его аналитическое выражение через КПД цикла.
2 закон термодинамики - любой реальный самопроизвольный процесс явля-
ется необратимым;
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
аналитическое выражение через КПД цикла.
 . В реальных процессах, Qx и Tx не может равнятся абсолютному нулю, что подтверждает второй закон термодинамики.
. В реальных процессах, Qx и Tx не может равнятся абсолютному нулю, что подтверждает второй закон термодинамики.
22. Влияние необратимости на КПД цикла. Выражение второго закона термодинамики через энтропию.
При осуществлении любого реального необратимого цикла КПД всегда меньше единицы,  .
.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
23.Энтропийные диаграммы чистого вещества в области фазового равновесия

24. Вычисление энтропии идеального газа и смеси идеальных газов. Энтропия смещения
+конспект
25. Оценка эффективности равновесных циклов
?????????
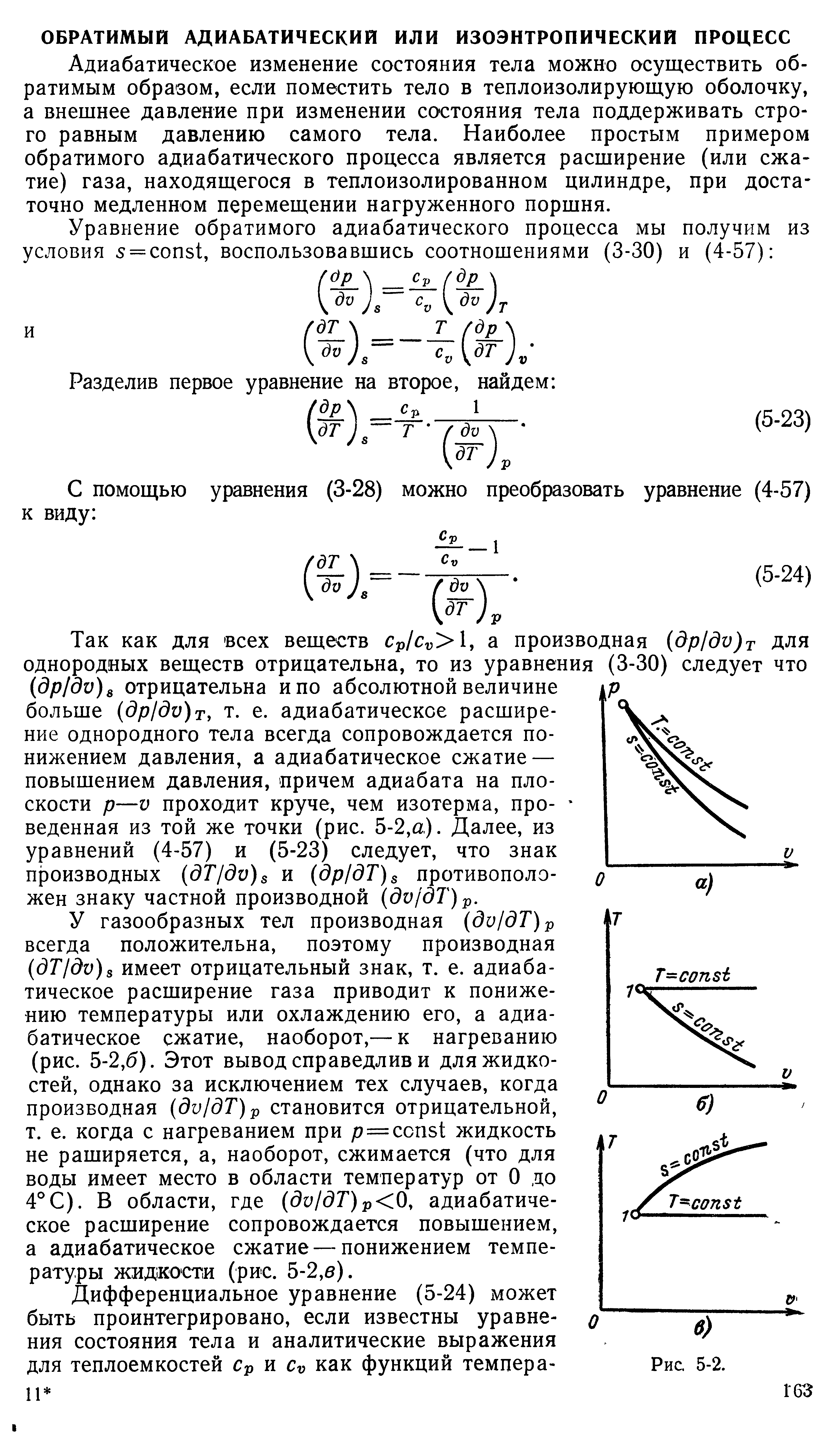
26. Адиабатный и изохорный процессы. Их характеристики






27. Изотермические и изобарные процессы. Их характеристики





28. Политропный процесс и его характеристики
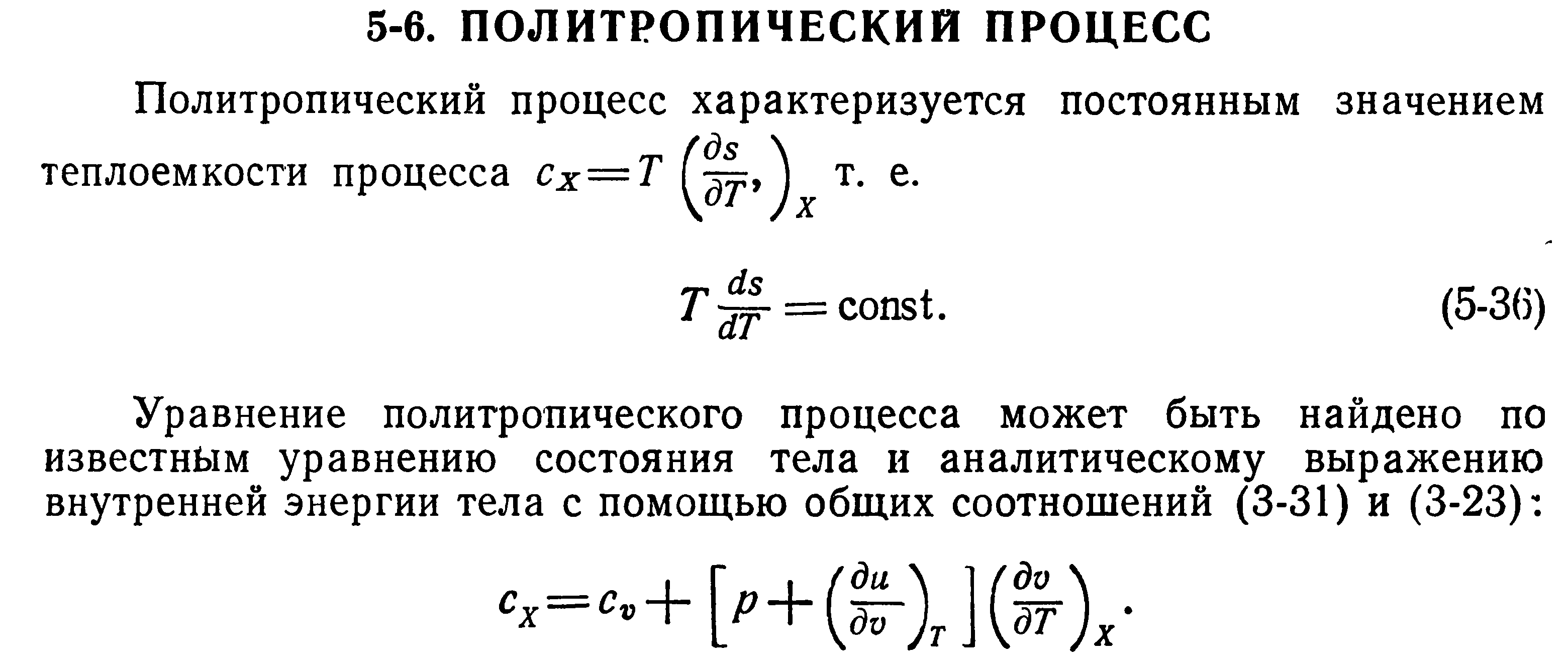


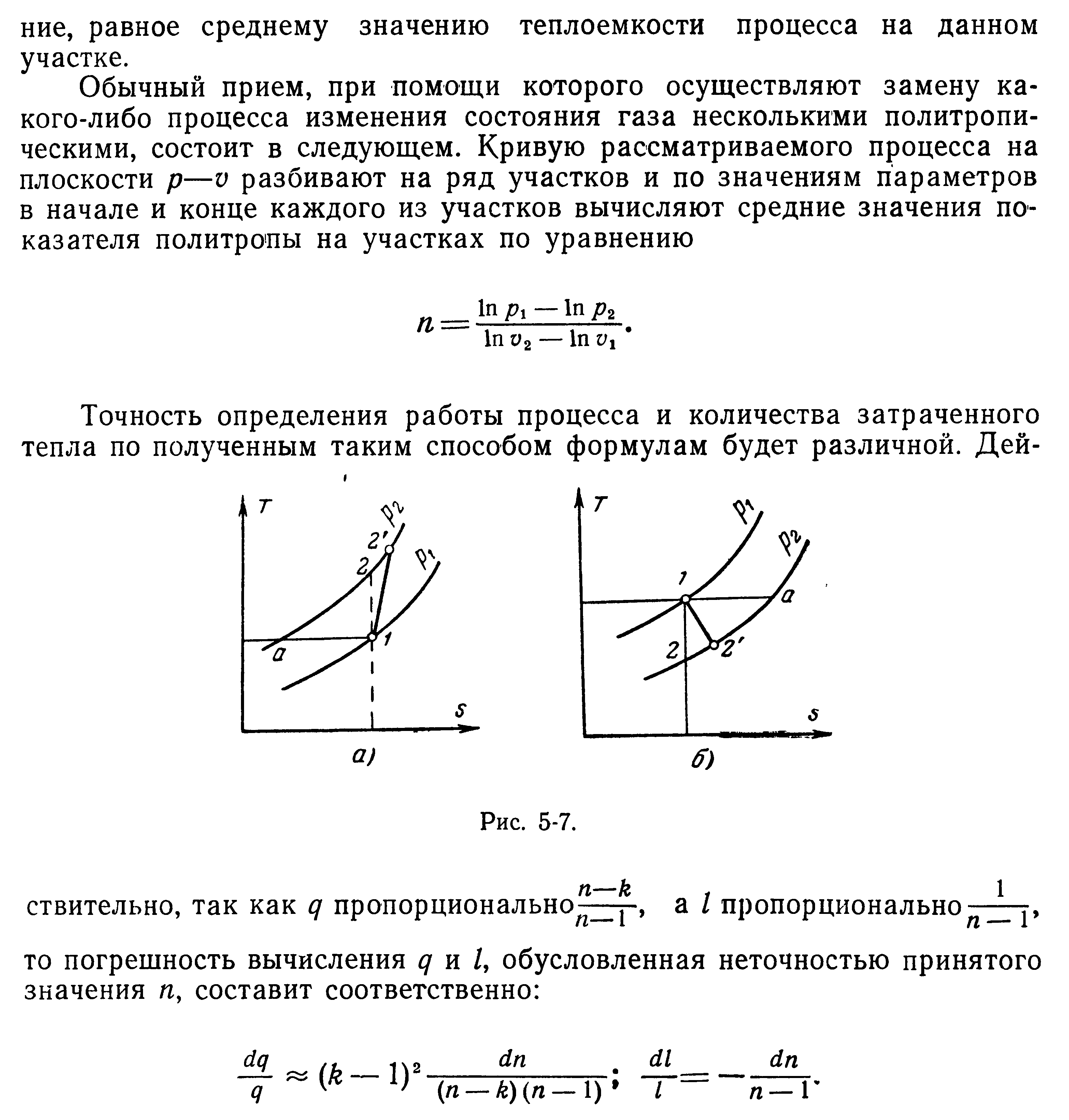


29. Процессы в потоке не совершающем техническую работу. Сопло и диффузор
Сопло – специально спрофилированный закрытый канал, предназначенный для разгона газов до заданной скорости и придания потоку заданного направления.
Дозвуковое сопло:

Сверхзвуковое сопло(Лаваля)
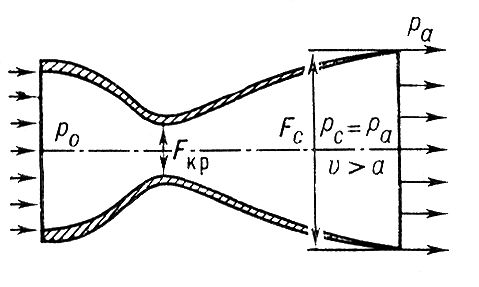
Диффузор – специально спрофилированный открытый канал, который снижает скорость потока и преобразует его кинетическую энергию в увеличение давления с минимальными потерями.
30. Истечение газа из ёмкости. Скорость звука и число Маха. Критические параметры
Скорость звука — скорость распространения упругих волн в среде.
Определяется упругостью и плотностью среды Скорость звука в однородной жидкости:
 ,
,
где β — адиабатическая сжимаемость среды; ρ — плотность.
Для газов:
 ,
,
где γ — показатель адиабаты; k — постоянная Больцмана; R — универсальная газовая постоянная; T — абсолютная температура в кельвинах; t — температура в градусах Цельсия; m — молекулярная масса; M — молярная масса.
Число Маха – это отношение скорости течения v в данной точке газового потока к местной скорости звука. М=v/a.
Число Маха, равное 1, выражает локальную скорость звука. Самолет, летящий со скоростью ниже 1 маха, считается дозвуковым, т.е. летящим со скоростью меньше скорости звука. Сверхзвуковой полёт означает полет со скоростью выше 1 маха.
Критические температура, давление и объем.
Газы могут быть превращены в жидкость сжатием при условии, что температура не превышает определенного для каждого газа значения.
Температура, при которой и выше которой данный газ не может быть сжижен никаким повышением давления, называется критической Ткр.
Давление, при котором и выше которого повышением температуры нельзя испарить жидкость, называется критическим ркр.
Объем газа, соответствующий критической температуре, называется критическим Vкр, а состояние газа, отвечающее критической температуре, критическому давлению и критическому объему, — критическим состоянием газа.
Под приведенной температурой понимается отношение абсолютной температуры газа к его критической температуре: Тпр = Т/Ткр.
Приведенным давлением называется отношение абсолютного давления газа к его абсолютному критическому давлению:
pпр = pабс/pкр.
31. Сопло Лаваля. Максимальная скорость при изоэнтропном истечении




32. Параметры заторможенного потока. Учет необратимых потерь при течении в соплах и диффузорах
Параметры газа, соответствующие нулевой скорости потока, называются параметрами торможения. Давление, плотность, температура и энтальпия, соответствующие этому состоянию называются давлением, плотностью, температурой и энтальпией торможения и обозначаются po, ro, To, io. Соотношение между местными параметрами потока и параметрами торможения определяются с помощью газодинамических функций t, p, e.
При встрече газового потока с твёрдым телом происходит его торможение. При этом кинетическая энергия потока переходит в теплоту и параметры потока переходят в параметры торможения.
Рассмотрим процесс адиабатного торможения, а именно установим связь между набегающим потоком и адиабатно заторможенным потоком газа:
Для этого запишем уравнение в виде: i1+ω1²/2=i2+ω2²/2, то для адиабатного потока можна записать і+ω²/2=const.
Энтальпия идеального газа i=CpT. Тогда СрТ+ω²/2=const.
Если адиабатный поток газа будет заторможен, то температура, которую приобретёт поток, называется температурой торможения То.
То, при Ср=const, получим: To=T+ ω²/2Cp.
Подставляя M=ω/а и a=√kRT, находим:
To/T=1+M²(k-1)/2; Po/P=(1+ M²(k-1)/2)в степени k/(k-1);
ρо/ρ=(1+ M²(k-1)/2)в степени k/(k-1);
Данные соотношения позволяют определить параметры То, Po, ρо заторможенного адиабатного потока, если известні параметрі невозмущённого потока.
33. Процессы в потоке с совершением технической работы. Компрессор и детандер

Дета́ндер (от франц. détendre — ослаблять) — устройство, преобразующее потенциальную энергию газа в механическую энергию. При этом газ, совершая работу, охлаждается. Используется в цикле получения жидких газов, таких как воздух и гелий. Наиболее распространены поршневые детандеры и турбодетандеры.
34. Термодинамический анализ процессов сжатия. Учет необратимых потерь
Большинство низкотемпературных процессов сжижения и разделения газов осуществляется за счет подвода механической или электрической энергии. При этом уравнение расхода энергии удобно представить в следующем виде:
L = Lmin + ΣПк (1)
где Lmin - минимальная работа, затрачиваемая на осуществление процесса (при обратимом его протекании); ΣПк - суммарные потери вследствие необратимости процессов сжатия, расширения, теплообмена, ректификации и т.п.
35. Цикл Брайтона и его термодинамический анализ.
Цикл Брайтона — термодинамический цикл, описывающий рабочие процессы газотурбинного, турбореактивного и прямоточного воздушно-реактивного двигателей внутреннего сгорания, а также газотурбинных двигателей внешнего сгорания с замкнутым контуром газообразного (однофазного) рабочего тела.
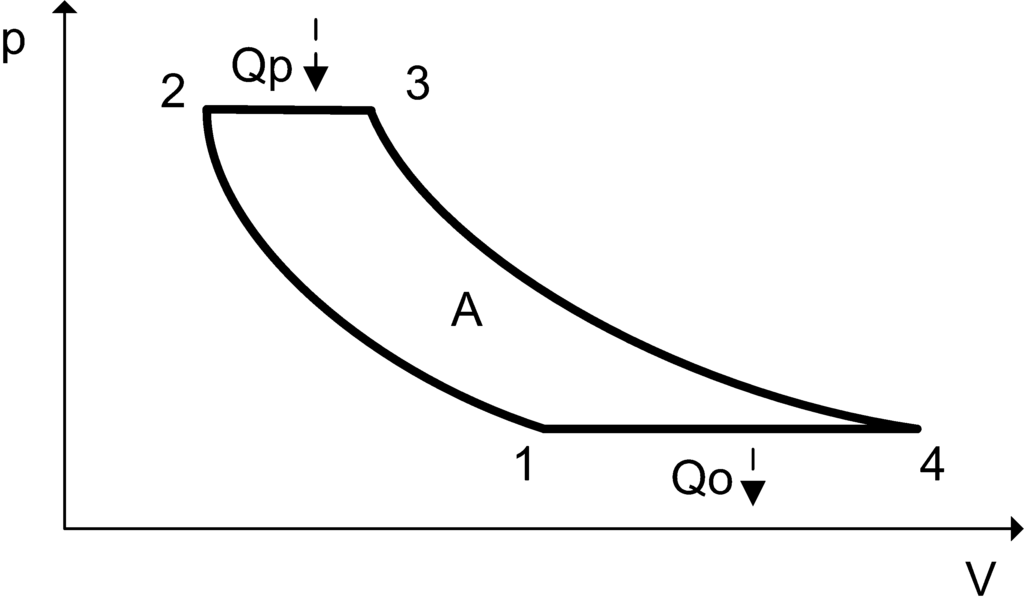 Идеальный цикл Брайтона состоит из процессов
Идеальный цикл Брайтона состоит из процессов
1—2 Изоэнтропическое сжатие.
2—3 Изобарический подвод теплоты.
3—4 Изоэнтропическое расширение.
4—1 Изобарический отвод теплоты.
 Термический КПД идеального цикла Брайтона принято выражать формулой:
Термический КПД идеального цикла Брайтона принято выражать формулой: 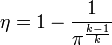 где
где 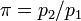 — степень повышения давления в процессе изоэнтропийного сжатия (1—2);
— степень повышения давления в процессе изоэнтропийного сжатия (1—2); 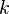 — показатель адиабаты (для воздуха равный 1,4)
— показатель адиабаты (для воздуха равный 1,4)
36. Циклы поршневых ДВС и их термодинамический анализ
Циклы поршневых двигателей внутреннего сгорания подразделяют на три группы: с подводом теплоты при постоянном объеме (карбюраторные ДВС); с подводом теплоты при постоянном давлении (компрессорные дизели); со смешанным подводом теплоты при постоянном объеме (безкомпрессорные дизели)
Крайне верхнее положения поршня у крышки головки цилиндра –; верхняя мертвая точка;нижняя – противоположная. Движение поршня между мертвыми точками называется такт. Ход поршня – длина пути между мертвыми точками. Рабочий объем – объем, описывающий поршнем за один ход
Основными характеристиками или параметрами любого цикла теплового двигателя являются следующие безрамерные величины:
степень сжатия (отношение удельных объемов рабочего тела в начале и конце сжатия) e = n1 / n2, (7.5)
степень повышения давления (отношение давлений в конце и в начале изохорного процесса подвода теплоты) l = Р3 / Р2, (7.6)
степень предварительного расширения или степень изобарного расширения (отношение удельных объемов в конце и в начале изохорного процесса подвода теплоты) r = n3 / n2. (7.7)
 Рассмотрим цикл ДВС с подводом теплоты при постоянном объеме на примере четырехтактного двигателя. Диаграмма реального двигателя представлена на рис.7.3. а-1 (1 такт) – в цилиндр через всасывающий клапан поступает смесь воздуха и паров горючего (нетермодинамичемкий процесс); 1-2 (2 такт) – адиабатное сжатие (повышается температура); 2-3 – сгорание горючей смеси, давление быстро возрастает при постоянном объеме (подвод теплоты q1); 3-4 (3 такт) – адиабатное расширение (рабочий процесс, совершается полезная работа); 4-а – открывается выхлопной клапан и отработанные газы покидают цилиндр давление цилиндра падает (отводится тепло q2). 1-а (4 такт) – выталкивание оставшихся в цилиндре газов. Затем процесс повторяется. Описанный процесс является необратимым (наличие трения, химической реакции в рабочем теле, конечные скорости поршня, теплообмен при конечной разности температур и т.п.).
Рассмотрим цикл ДВС с подводом теплоты при постоянном объеме на примере четырехтактного двигателя. Диаграмма реального двигателя представлена на рис.7.3. а-1 (1 такт) – в цилиндр через всасывающий клапан поступает смесь воздуха и паров горючего (нетермодинамичемкий процесс); 1-2 (2 такт) – адиабатное сжатие (повышается температура); 2-3 – сгорание горючей смеси, давление быстро возрастает при постоянном объеме (подвод теплоты q1); 3-4 (3 такт) – адиабатное расширение (рабочий процесс, совершается полезная работа); 4-а – открывается выхлопной клапан и отработанные газы покидают цилиндр давление цилиндра падает (отводится тепло q2). 1-а (4 такт) – выталкивание оставшихся в цилиндре газов. Затем процесс повторяется. Описанный процесс является необратимым (наличие трения, химической реакции в рабочем теле, конечные скорости поршня, теплообмен при конечной разности температур и т.п.).
 Для анализа теории тепловых машин термодинамика рассматривает идеальные циклы обратимые циклы. Диаграмма идеального процесса двигателя внутреннего сгорания показана на рис.7.4. Из этой диаграммы выводится формула для термического к.п.д. цикла с подводом теплоты при постоянном объеме, который имеет следующий вид: ht = 1 – 1/eg, (7.8) где: e –степень сжатия (основной показатель работы двигателя, чем выше е, тем выше экономичность ДВС); g – показатель адиабаты.
Для анализа теории тепловых машин термодинамика рассматривает идеальные циклы обратимые циклы. Диаграмма идеального процесса двигателя внутреннего сгорания показана на рис.7.4. Из этой диаграммы выводится формула для термического к.п.д. цикла с подводом теплоты при постоянном объеме, который имеет следующий вид: ht = 1 – 1/eg, (7.8) где: e –степень сжатия (основной показатель работы двигателя, чем выше е, тем выше экономичность ДВС); g – показатель адиабаты.
 2). Идеальный цикл ДВС со смещанным подводом теплоты при постоянном объеме (безкомпрессорные дизели). Диаграмма цикла показана на рис.7.5. 1-2 - чистый воздух с температурой Т1 сжимается до температуры Т2, которая больше температуры воспламенения топлива. В этот момент в цилиндр через форсунки под давлением впрыскивается топливо. 2-3 – горючая смесь самовоспламеняется и к рабочему телу подводится тепло q1/, давление повышается до Р3. 3-4 – поршень перемешается обратно, поступление и сгорание топлива продолжается при постоянном давлении и подводится тепло q1//. 4-5 – поршень продолжает перемещаться в нижнюю мертвую точку, давление падает (адиабатное расширение); 5-1 – процесс отвода теплоты q2 при постоянном объеме (через выпускной клапан покидают отработанные газы). Термический к.п.д. цикла определяется по формуле: ht = l – (l·rg – 1) / eg-1·[(l - 1) + g·l·(r – 1)]. (7.9) Цикл двигателей с подводом теплоты при постоянном давлении широкое применение не нашли, так как у этих циклов очень большой коэффициент сжатия.
2). Идеальный цикл ДВС со смещанным подводом теплоты при постоянном объеме (безкомпрессорные дизели). Диаграмма цикла показана на рис.7.5. 1-2 - чистый воздух с температурой Т1 сжимается до температуры Т2, которая больше температуры воспламенения топлива. В этот момент в цилиндр через форсунки под давлением впрыскивается топливо. 2-3 – горючая смесь самовоспламеняется и к рабочему телу подводится тепло q1/, давление повышается до Р3. 3-4 – поршень перемешается обратно, поступление и сгорание топлива продолжается при постоянном давлении и подводится тепло q1//. 4-5 – поршень продолжает перемещаться в нижнюю мертвую точку, давление падает (адиабатное расширение); 5-1 – процесс отвода теплоты q2 при постоянном объеме (через выпускной клапан покидают отработанные газы). Термический к.п.д. цикла определяется по формуле: ht = l – (l·rg – 1) / eg-1·[(l - 1) + g·l·(r – 1)]. (7.9) Цикл двигателей с подводом теплоты при постоянном давлении широкое применение не нашли, так как у этих циклов очень большой коэффициент сжатия.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 7588; Нарушение авторских прав?; Мы поможем в написании вашей работы!