
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы и уравнения состояния идеальных газов
З-1.5
З-1.4
З-1.3
З-1.2
З-1.1
Задачи
П-1.2
Решение.
П-1.1
Примеры
Найти абсолютное давление пара в котле, приведенное к 0ºС, если манометр показывает р = 0,13 МПа, а атмосферное давление по ртутному барометру составляет 680 мм рт. ст. (90660 Па) при температуре t = 25 ºС.
Из уравнения (1.4)
рабс = ратм + рман.
Показание барометра, полученное при t = 25 ºС приводим к 0 ºС.
В0 = В( 1 – 0,000172 t) = 90660·0,9957 = 90270 Па.
Тогда абсолютное давление пара в котле
рабс = 0,13 + 0,09 = 0,22 МПа.
Избыточное давление в паровом котле р = 0,04 МПа при барометрическом давлении В01 = 96660 Па (725 мм рт. ст.). Чему будет равно избыточное давление в котле, если показание барометра повысится до В02 = 104660 Па, а состояние пара в котле останется прежним? Барометрическое давление приведено к 0 ºС.
Абсолютное давление в котле
рабс = 40000 + 96660 = 136660 Па.
Избыточное давление при показании барометра В02 = 104660 Па.
рман = 136660 – 104660 = 32000 Па.
Для измерения малых избыточных или вакуумметрических давлений применяются микроманометры (рис. 1). Определить абсолютное давление в воздухопроводе 1, если длина столба жидкости в трубке микроманометра 2, наклоненной под углом α = 30º, равна 180 мм. Рабочая жидкость – спирт плотностью r = 0,8 г/см3. Показание барометра 0,102 МПа. Давление выразить в МПа, мм рт. ст., кг/см2.
Ответ: рабс = 0,1027 МПа = 770 мм рт. ст. = 1,047 кг/см2.

Рис. 1
Определить абсолютное давление в паровом котле, приведенное к 0 ºС, если манометр показывает 0,245 МПа, а атмосферное давление по ртутному барометру составляет В = 93325 Па (700 мм рт. ст.) при
t = 20 ºС.
Ответ: р = 0,338 МПа.
Разряжение в газоходе 1 парового котла измеряется тягомером с наклонной трубкой 2 (рис. 2). Угол наклона трубки α = 30º, длина столба воды l = 160 мм. Определить абсолютное давление газов, если показание ртутного барометра, приведенное к 0 ºС, В0 = 98,7 кПа.
Ответ: р = 97,9 кПа.
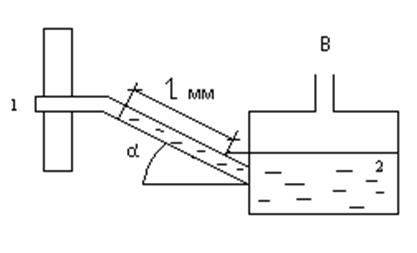
Рис. 2
Для предупреждения испарения ртути, обычно при пользовании ртутными манометрами над уровнем ртути наливают столб воды.
Определить абсолютное давление в сосуде, если разность столбов ртути в U-образном манометре составляет 580 мм рт. ст. при температуре 25 ºС, а высота столба воды над ртутью равна 150 мм. Атмосферное давление по ртутному барометру В = 102,7 кПа при t = 25 ºС.
Ответ: р = 0,18 МПа.
Разряжение в газоходе измеряется тягомером и равно 412 Па
(42 мм вод. ст.). Атмосферное давление по ртутному барометру
В = 100925 Па (757 мм рт. ст.) при t = 15 ºС. Определить абсолютное давление дымовых газов.
Ответ: р = 100250 Па.
Под идеальным газом понимают воображаемый газ, в котором отсутствуют силы притяжения между молекулами, а собственный объем молекул исчезающе мал по сравнению с объемом междумолекулярного пространства. Таким образом, молекулы идеального газа принимают за материальные точки. В действительно существующих газах при высоких температурах и малых давлениях можно пренебречь силами притяжения иобъёмом самих молекул. Поэтому такие газы можно также считать идеальными.
В тех газах, которые находятся в состояниях, достаточно близких к сжижению, нельзя пренебречь силами притяжения между молекулами и объемом последних. Такие газы нельзя отнести к идеальным, и их называют реальными газами.
Основное уравнение кинетической теории газов имеет вид
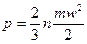 , (2.1)
, (2.1)
где р – давление идеального газа;
n – число молекул в 1 м3 газа (концентрация молекул);
т – масса одной молекулы;
w – средняя квадратичная скорость поступательного движения молекул;
 - средняя кинетическая энергия поступательного движения одной молекулы.
- средняя кинетическая энергия поступательного движения одной молекулы.
Таким образом, основное уравнение кинетической теории газов устанавливает связь между давлением газа, средней кинетической энергией поступательного движения молекул и их концентрацией.
Основные зависимости, характеризующие соотношение между параметрами идеального газа при некоторых вполне определенных условиях изменения его состояния, легко получаются из основного уравнения кинетической теории газов.
Для газов, взятых при одинаковых температурах и давлениях, имеет место следующая зависимость, полученная на основе закона Авогадро:
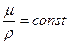 , (2.2)
, (2.2)
где μ - молекулярная масса газа, кг/кмоль.
Так как, согласно (1.2) 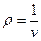 , то
, то
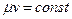 . (2.3)
. (2.3)
Величина μv представляет собой объем килограмм-молекулы или киломоля (кмоль) газа. Так как в 1 м3 газа могут содержаться, в зависимости от параметров его состояния, разные количества газа, принято относить 1 м3 газа к так называемым нормальным условиям (н.у.), при которых рабочее вещество находится под давлением р = 101325 Па и Т = 273,15 К (760 мм рт. ст. и 0 ºС). Объем кмоля всех идеальных газов равен Vμ = 22,4136 м3/кмоль при н.у. Плотность и удельный объем любого газа при н.у. определяются из равенств
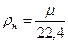 кг/м3;
кг/м3; 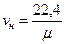 нм3/кг. (2.4)
нм3/кг. (2.4)
Характеристическое уравнение идеального газа или уравнение состояния связывает между собой основные параметры состояния – давление, объем и температуру – и может быть представлено следующими уравнениями, каждое из которых отличается от другого тем, что относится к различным массам газа: первое – к общей массе в кг, второе – к 1 кг, третье – к 1 кмолю газа (уравнение Клапейрона–Менделеева):
pV = MRT, (2.5)
pv = RT, (2.6)
pVμ = μRT, (2.7)
где р – давление газа в Па;
V – объем газа в м3;
М – масса газа в кг;
v – удельный объем газа в м3/кг;
Vμ – молярный объем газа в м3/кмоль;
R – газовая постоянная для 1 кг газа в Дж/(кг·К);
μR – универсальная газовая постоянная 1 кмоля газа в Дж/(кмоль·К).
Численное значение универсальной газовой постоянной получается из уравнения (2.7) при подстановке значений входящих в него величин при н.у.:
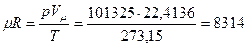 Дж/(кмоль·К). (2.8)
Дж/(кмоль·К). (2.8)
Газовую постоянную, отнесенную к 1 кг газа, определяют из уравнения
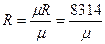 Дж/(кг·К), (2.9)
Дж/(кг·К), (2.9)
где μ – масса 1 кмоля газа, кг (численно равная молекулярной массе газа).
Пользуясь характеристическим уравнением для двух различных состояний какого-либо газа, можно получить выражение для определения любого параметра при переходе от одного состояния к другому, если значения остальных параметров известны:
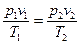 , (2.10)
, (2.10)
 . (2.11)
. (2.11)
Уравнение (2.10) можно переписать следующим образом:

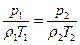 , (2.12)
, (2.12)
следовательно, можно определить плотность газа при переходе из одного состояния в другое:
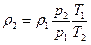 , кг/м3. (2.13)
, кг/м3. (2.13)
|
|
Дата добавления: 2015-05-09; Просмотров: 4655; Нарушение авторских прав?; Мы поможем в написании вашей работы!