
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 9.Теплоемкость, методы определения теплоемкости
|
|
|
|
Вопрос 8
Средняя молекулярная масса смеси газов, зависимость между массовыми и объемными долями, пересчет массового состава в объемный и обратно.
Вопрос 7
Вопрос 6
Смеси газов и паров.Способы задания смеси. Закон дальтона. Парциальное давление и объем.
Теплоемкость вещества, способы задания теплоемкости, их размеренность соотношение между ними. Факторы влияющие на величину теплоемкости.
Теплоемкость величина переменная, зависящая от температуры и давления, а для идеальных газов только от температуры, причем в ряде случаев эта зависимость может быть значительной Поэтому теплоемкость определяют уравнением Czm=gz/(T2-T1), называют средней теплоемкостью Cpm, Cvm в отличии от так называемой истиной теплоемкости, определяемой для заданной температуры и обозначаемой Cp и Cv
В тепловых расчетах обычно используется средними теплоемкостями:
Массовой теплоемкостью называют количество теплоты необходимой для нагрева единицы массы вещества (обычно 1 кг на 1 градус Цельсия)
Мольной теплоемкостью называется количество теплоты, необходимой для нагрева одного киломоля на один градус в данном процессе.
Объемной теплоемкостью называется количество теплоты необходимой для нагрева единицы объема вещества (ОБЫЧНО 1м^3 НА 1 градус)
Поршневые компрессоры применяются в текстильном производстве, машиностроении, криогенной технике, химической и холодильной промышленности. Поршневые промышленные компрессоры различают по устройству компрессора и расположению цилиндров, устройству шатунного механизма и числу степеней сжатия.
Теплоемкость, количество теплоты, затрачиваемое для изменения температуры на 1°С. Согласно более строгому определению, теплоемкость - термодинамическая величина, определяемая выражением:
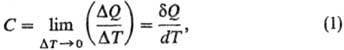
где Δ Q - количество теплоты, сообщенное системе и вызвавшее изменение ее температуры на Delta;T. Отношение конечных разностей Δ Q /ΔТ называется средней теплоемкостю, отношение бесконечно малых величин d Q/dT - истинной теплоемкостю. Поскольку d Q не является полным дифференциалом функции состояния, то и теплоемкость зависит от пути перехода между двумя состояниями системы. Различают теплоемкость системы в целом (Дж/К), удельную теплоемкость [Дж/(г·К)], молярную теплоемкость [Дж/(моль·К)]. Во всех ниже приведенных формулах использованы молярные величины теплоемкости.
Из второго начала термодинаики слует, что теплоемкость пропорциональна производной от энтропии системы S по температуре Т при постоянстве внешней силы или термодинамической координаты (обозначается индексом z):

Наиболее важными видами теплоемкости являются теплоемкость CV при постоянном объеме V и теплоемкость Ср при постоянном давлении р:
СV =(∂ U/∂T) V = T (∂ S/∂T) V, Ср= (∂ Н/∂Т) р=Т (∂ S/∂Т) р,
где U - внутренняя энергия, H - энтальпия системы. Значения Ср и СV связаны соотношением:

где a= V -1(∂ V /∂ Т) р - коэффициент термического расширения, x =— V -1(∂ V /∂ р) T - коэффициент изотермической сжимаемости. Поскольку по условиям устойчивости фаз Ср, CV >0 и (∂ V /∂ р) T <0, то согласно (3) Ср>CV. Это естественно, т.к. при изобарическом нагревании часть тепла, помимо увеличения внутренней энергии системы, идет на работу расширения. Для идеальных газов (∂ U /∂ V) T =0 и учет уравнения состояния pV=RT приводит к соотношению: Сp-CV = R (R - газовая постоянная). Для адиабатического процесса С = 0.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2547; Нарушение авторских прав?; Мы поможем в написании вашей работы!