
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость газов. Вычисление теплоемкости сводится к вычислению средней энергии теплового движения отдельных молекул, которое складывается из поступательных и вращательных
|
|
|
|
Вычисление теплоемкости сводится к вычислению средней энергии теплового движения отдельных молекул, которое складывается из поступательных и вращательных движений молекулы как целого и из колебаний атомов внутри молекулы. Молярная теплоемкость одноатомного газа равна 3 R /2. Теплоемкость многоатомного газа в общем случае может быть представлена суммой вкладов от отдельных видов движения - поступательного, вращательного, колебательного.
Поступательная теплоемкость рассчитывается так же, как для одноатомного газа. Вращательная и в особенности колебательная теплоемкости должны, как правило, вычисляться на основе квантовой статистики. Согласно классической статистике, вклады в молярную теплоемкость в расчете на одну степень свободы равны: для вращательного движения R /2, для колебательного движения R. Для большинства молекул при низких и средних температурах колебательные степени свободы вырождены и не дают вклада в теплоемкость Например, теплоемкость двухатомного газа при обычных температурах равна 5 R /2. Лишь при достаточно высоких температурах возбуждаются колебания определенной частоты.
Основным экспериментальным методом является калориметрия. Теоретический расчет теплоемкости веществ осуществляется методами статистической термодинамики, но он возможен только для сравнительно простых молекул в состоянии идеального газа и для кристаллов, причем в обоих случаях для расчета требуются экспериментальные данные о строении вещества.
Эмпирические методы определения теплоемкости веществ в состоянии идеального газа основаны на представлении об аддитивности вкладов отдельных групп атомов или химических связей. Опубликованы обширные таблицы групповых атомных вкладов в значение Ср. Для жидкостей, помимо аддитивно-групповых, применяют методы, основанные на соответственных состояний законе, а также на использовании термодинамических циклов, позволяющих перейти к теплоемкости жидкости от теплоемкости идеального газа через температурную производную энтальпии испарения.
Для раствора вычисление теплоемкости как аддитивной функции теплоемкостей компонентов в общем случае некорректно, т.к. избыточная теплоемкость раствора, как правило, значительна. Для ее оценки требуется привлечение молекулярно-статистической теории растворов. Экспериментально избыточная теплоемкость может быть определена по температурной зависимости энтальпии смешения, после чего возможен расчет Ср р-ра.
Теплоемкость гетерогенных систем представляет наиболее сложный случай для термодинамического анализа. На диаграмме состояния перемещение вдоль кривой равновесия фаз сопровождается изменением и р, и T / Если в процессе нагрева происходит смещение точки фазового равновесия, то это дает дополнительный вклад в теплоемкость, поэтому теплоемкость гетерогенной системы не равна сумме теплоемкостей составляющих ее фаз, но превосходит ее. На фазовой диаграмме при переходе от гомогенного состояния к области существования гетерогенной системы теплоемкость испытывает скачок.
Практическое значение исследований теплоемкости важно для расчетов энергетических балансов процессов в химических реакторах и др. аппаратах химического производства, а также для выбора оптимальных теплоносителей. Экспериментальное измерение теплоемкости для разных интервалов температур - от предельно низких до высоких - является основным методом определения термодинамических свойств веществ. Для расчета энтальпий и энтропии вещества (в интервалах от 0 до Т) используют интегралы от теплоемкости:
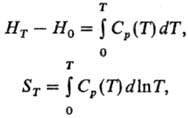
к которым добавляются соответствующие эффекты фазовых переходов. Знание теплоемкости реагентов в некотором интервале температур позволяет осуществить расчет теплового эффекта реакции, а знание теплоемкостей растворов - рассчитать их термодинамические свойства при любой температуре в пределах исследованного интервала.
Особо следует подчеркнуть роль теплоемкости в структурных исследованиях индивидуальных веществ в конденсированном состоянии и растворов. Величины, являющиеся второй производной потенциалов Гиббса или Гельмгольца по параметрам состояния (а теплоемкость относится к таковым), весьма чувствительны к структурным изменениям системы. В твердых телах и сплавах при фазовых переходах 2-го рода типа порядок - беспорядок наблюдаются l-образные скачки теплоемкости. В жидкостях такие скачки имеют место вблизи критических точек равновесия жидкость-газ и жидкость-жидкость. В жидкости, например, при нагревании часть энергии может идти не на возбуждение новых степеней свободы молекул, а на изменение потенциальной энергии взаимодействующих молекул. Этот вклад называется "конфигурационной" теплоемкостью; она связана с характером молекулярного упорядочения в жидкостях и растворах. В биохимии политермические измерения теплоемкости дают информацию о структурных переходах в белках.
Вопрос 10
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1179; Нарушение авторских прав?; Мы поможем в написании вашей работы!