
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение внутренней энергии термодинамической системы DU равно разности полученного количества теплоты Q и работы A, совершенной системой
|
|
|
|
Первый закон термодинамики является законом сохранения энергии для тепловых процессов. Согласно ему A = Q – DU. Этот закон говорит о том, что любая машина (любой двигатель) может совершать работу только за счет получения извне некоторого количества теплоты или уменьшения своей внутренней энергии. Многие изобретатели пытались построить машины, которые совершали бы работу, не тратя никакой энергии. Эти машины назывались вечными двигателями первого рода.
Вечный двигатель первого рода не возможен – таков вывод из первого закона термодинамики.
Вопрос 11
В современной физике существует следующая классификация термодинамических систем по признаку их возможности обмена энергией и веществом с окружающей средой или с другими системами:
а) Система открытая, если возможен обмен энергией и веществом.
б) Система закрытая, если обмен энергией возможен, а обмен веществом невозможен.
Закрытые системы дополнительно подразделяются по признаку возможности осуществления энергообмена следующим образом:
а) Система замкнутая, если энергообмен возможен, но невозможен обмен с внешней средой путем совершения механической работы.
б) Система изолированная, если невозможен обмен системы с окружающей средой ни энергией, ни веществом.
в) Система адиабатная, если полностью отсутствует теплообмен системы с окружающей средой.
В адиабатной системе возможен как обратимый, так и необратимый адиабатный процесс. Обратимый адиабатный процесс называется также изоэнтропийным процессом, что подчеркивает постоянство энтропии в адиабатной системе. А постоянство энтропии означает отсутствие необратимых диссипативных потерь энергии.
определение физической системы, принятое в современной физике, ограничивается лишь статической составляющей физических систем. Соответственно, и современная термодинамика рассматривает только квазистатические обратимые процессы. Поэтому в термине “термодинамические системы“, как его понимают сегодня, присутствие второй половины слова “динамические“ следует поставить под вопрос, так как слово “динамика“ обычно связано с движением и, следовательно, с необратимыми диссипативными потерями.
Систематизация физических величин, основанная на принципах энергодинамики, не может ограничиться вышеприведенной классификацией термодинамических систем. Потому что в указанной классификации не учитываются ни динамика энергообмена между системой и окружающей средой, ни необратимые диссипативные потери.
Таким образом, физические системы, как более обобщающее понятие по сравнению с термодинамическими системами, нуждаются в дополнительной классификации. Она рассмотрена на странице, посвященной классификации физических систем.
4.2.1.Изохорный процесс (v=const)
Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) при v=const. В pv -координатах график процесса представляет собой прямую линию, параллельную оси p. Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’).
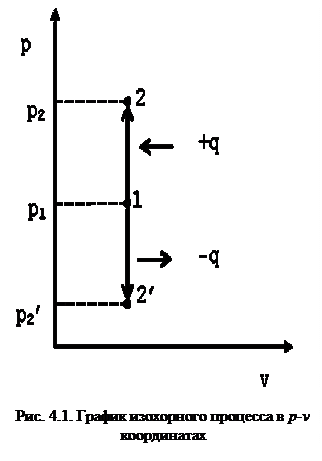 Запишем для точек 1 и 2 уравнения состояния: p1·v=R·T1; p2·v=R·T2. Следовательно, для изохорного процесса
Запишем для точек 1 и 2 уравнения состояния: p1·v=R·T1; p2·v=R·T2. Следовательно, для изохорного процесса

Приращение внутренней энергии газа

Работа газа

так как dv=0.
Энтальпия газа iv=u+p·v, а div=du+d(p·v)=du+p·dv+v·dp=du+v·dp. Поэтому

Энтропия 
4.2.2.Изобарный процесс (p=const)
В p-v координатах график процесса представляет собой прямую линию параллельную оси v (рис. 4.2). Изобарный процесс может протекать с увеличением объёма (процесс 1-2) и с уменьшением (процесс 1-2’).
4.2.3.Изотермический процесс (T=const)
В p-v координатах график процесса изображается равнобокой гиперболой (рис. 4.3). Изотермический процесс может протекать как с увеличением объёма, так и с уменьшением объёма
4.2.5. Политропный процесс
Политропным процессом называется любой произвольный процесс изменения состояния рабочего тела, происходящий при постоянной теплоёмкости
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 492; Нарушение авторских прав?; Мы поможем в написании вашей работы!