
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Проверка исходного уровня проводится в письменной форме (тест) по химии растворов
|
|
|
|
Вводный контроль.
Примеры тестовых заданий:
1. Термодинамика изучает:
1) скорости протекания химических превращений и механизмы этих превращений;
2) энергетические характеристики физических и химических процессов и способность химических систем выполнять полезную работу;
3) условия смещения химического равновесия;
4) влияние катализаторов на скорость биохимических процессов.
2. Открытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
3. Закрытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
4. Изолированной системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией;
5. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещенной в термостат?
1) изолированной; 2) открытой; 3) закрытой; 4) стационарной.
6. К какому типу термодинамических систем принадлежит живая клетка?
1) открытой; 2) закрытой; 3) изолированной; 4) равновесной.
7. Какие величины являются функциями состояния системы: a) внутренняя энергия; б) работа; в) теплота; г) энтальпия; д) энтропия.
1) а, г, д; 2) б, в; 3) все величины; 4) а, б, в, г.
8. Отражает связь между работой, теплотой и внутренней энергией системы:
1) второй закон термодинамики; 2) закон Гесса;
3) первый закон термодинамики; 4) закон Вант – Гоффа.
9. Первый закон термодинамики отражает связь между:
1) работой, теплотой и внутренней энергией;
2) свободной энергией Гиббса, энтальпией и энтропией системы;
3) работой и теплотой системы;
4) работой и внутренней энергией.
10. Укажите формулировку закона Гесса:
1) тепловой эффект реакции зависит только от начального и конечного состояния системы инее зависит от пути реакции;
2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы;
3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системой;
4) тепловой эффект реакции не зависит от начального и конечного состояния системы, а зависит от пути реакции.
11. Математическим выражением первого закона термодинамики для закрытых систем является:
1) ΔU = 0 2) ΔU = Q ̶ р·ΔV 3) ΔG = ΔH ̶ T · ΔS 4) ΔS > 0
12. Тепловой эффект реакции, протекающий при постоянном объеме, называется изменением:
1) энтальпии; 2) внутренней энергии; 3) энтропии; 4) свободной энергии Гиббса.
13. Энтальпия реакции – это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно – изотермических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно – изотермических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
14. Химические процессы, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, называются:
1) эндотермическими; 2) экзотермическими;
3) экзэргоническими; 4) эндэргоническими.
15. Тепловой эффект реакции, протекающий при постоянном давлении, называется изменением:
1) внутренней энергии; 2) энтропии; 3) энтальпии;
4) ни одно из предыдущих определений неверно.
16. Процессы называются эндотермическими:
1) для которых ΔН отрицательно; 2) для которых ΔG отрицательно;
3) для которых ΔН положительно; 4) для которых ΔG положительно.
17. Процессы называются экзотермическими:
1) для которых ΔН отрицательно; 2) для которых ΔG отрицательно;
3) для которых ΔН положительно; 4) для которых ΔG положительно.
18. Какой закон лежит в основе расчетов калорийности продуктов питания?
1) Вант – Гоффа; 2) Гесса; 3) Сеченова; 4) Рауля.
19. При окислении, каких веществ в условиях организма выделяется большее количества энергии?
1) белков; 2) жиров; 3) углеводов; 4) углеводов и белков.
20. Самопроизвольным называется процесс, который:
1) осуществляется без помощи катализатора;
2) сопровождается выделением теплоты;
3) осуществляется без затраты энергии извне;
4) протекает быстро.
21. Энтропии реакции – это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно – изотермических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно – изотермических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц.
22. Тенденция системы к достижению вероятного состояния, которому соответствует максимальная беспорядочность распределения частиц, характеризуется функцией состояния:
1) энтальпией; 2) энтропией;
3) энергией Гиббса; 4) внутренней энергией.
23. В каком соотношении находятся энтропии трех агрегатных состояний одного вещества: газа, жидкости, твердого тела:
1) S (г) > S (ж) > S (г); 2) S (тв.) > S (ж) > S (г); 3) S (ж) > S (г) > S (тв.)
4) агрегатное состояние не влияет на значение энтропии.
24. Наибольшее положительное изменение энтропии должно наблюдаться в случае:
1) СН3ОН (тв.) → СН3ОН (г); 2) СН3ОН (тв.) → СН3ОН (ж);
3) СН3ОН (г) → СН3ОН (тв.); 4) СН3ОН (ж) → СН3ОН (тв.)
25. Энтропия системы увеличивается при:
1) повышении давления;
2) переходе от жидкого к твердому агрегатному состоянию;
3) повышении температуры;
4) переходе от газообразного к жидкому состоянию.
26. Математическим выражением 2-го закона термодинамики для изолированных систем является:
1) ΔU = 0; 2) ΔS ≥ 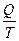 ; 3) ΔS ≤
; 3) ΔS ≤ 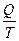 ; 4) ΔН = 0.
; 4) ΔН = 0.
27. Процессы называют эндэргоническими, если:
1) ΔН < 0; 2) ΔG < 0; 3) ΔН > 0; 4) ΔG > 0.*
28. Процессы называют экзэргоническими, если:
1) ΔН < 0; 2) ΔG < 0; 3) ΔН > 0 4) ΔG > 0
29. Самопроизвольный характер процесса лучше определять путем оценки:
1) энтропии; 2) энтальпии; 3) свободной энергии Гиббса; 4) температуры.
30. Для предсказания возможности самопроизвольного протекания процессов в живом организме можно использовать термодинамическую функцию:
1) энтальпию; 2) энтропию;
3) внутреннюю энергию; 4) свободную энергию Гиббса.
31. Укажите знак ΔG процесса таяния льда при 263 К?
1) ΔG > 0; * 2) ΔG = 0; 3) ΔG < 0; 4) ΔG ≤ 0.
32. Реакция неосуществима при любых температурах в случае:
1) ΔН > 0 и ΔS > 0; 2) ΔН > 0 и ΔS < 0;
3) ΔН < 0 и ΔS < 0; 4) ΔН = 0 и ΔS = 0.
33. Реакция возможна при любых температурах в случае:
1) ΔН < 0 и ΔS > 0; 2) ΔН < 0 и ΔS < 0;
3) ΔН > 0 и ΔS > 0; 4) ΔН = 0 и ΔS = 0.
34. Если ΔН < 0 и ΔS < 0, то, реакция может протекать самопроизвольно в случае:
1) [ΔН] > [T·ΔS]; 2) при любых соотношениях ΔН и Т·ΔS;
3) [ΔН] < [T·ΔS]; 4) [ΔН] = [T·ΔS].
35. При каких значениях по знаку ΔН и ΔS в системе возможны только экзотермические процессы?
1) ΔН > 0, ΔS > 0; 2) ΔН < 0, ΔS > 0; 3) ΔН < 0, ΔS < 0; 4) ΔН > 0, ΔS < 0.
36. При каких соотношениях ΔН и Т·ΔS химический процесс направлен в сторону эндотермической реакции?
1) ΔН < Т·ΔS; 2) ΔН > Т·ΔS; 3) ΔН = Т·ΔS; 4) ΔН Т·ΔS
37. Калорийностью питательных веществ называется энергия:
1) выделяемая при полном окислении 1 г питательных веществ;
2) выделяемая при полном окислении 1 моль питательных веществ;
3) необходимая для полного окисления 1 г питательных веществ;
4) необходимая для полного окисления 1 моль питательных веществ.
38. Функциями состояния термодинамической системы называют такие величины, которые:
1) зависят только от начального и конечного состояния системы;
2) зависят от пути процесса;
3) зависят только от начального состояния системы;
4) зависят только от конечного состояния системы.
39. Процессы, протекающие при постоянной температуре, называются:
1) изобарическими; 2) изотермическими;
3) изохорическими; 4) адиабатическими.
40. Процессы, протекающие при постоянном объеме, называются:
1) изобарическими; 2) изотермическими;
3) изохорическими; 4) адиабатическими.
41. Процессы, протекающие при постоянном давлении, называются:
1) изобарическими; 2) изотермическими;
3) изохорическими; 4) адиабатическими.
41. Внутренняя энергия системы – это:
1) весь запас энергии, кроме потенциальной энергии ее положения и кинетической энергии системы в целом;
2) весь запас энергии системы;
3) весь запас энергии, кроме потенциальной энергии ее положения;
4) величина, характеризующая меру неупорядоченности расположения частиц системы.
42. В изолированной системе самопроизвольно протекает химическая реакция с образованием некоторого количества продукта. Энтропия такой системы:
1) уменьшается; 2) увеличивается; 3) не изменяется; 4) достигает максимального значения.
43. Направленность химического процесса одновременно определяется действующими факторами:
1) энтальпийным и температурным; 2) энтальпийным и энтропийным;
3) энтропийным и температурным; 4) изменением энергии Гиббса и температуры.
44. В изобарно-изотермических условиях максимальная работа, осуществляемая системой:
1) равна убыли энергии Гиббса; 2) больше убыли энергии Гиббса;
3) меньше убыли энергии Гиббса; 4) равна убыли энтальпии.
45. Для обратимых процессов изменение свободной энергии Гиббса….
1) всегда равно нулю; 2) всегда отрицательно; 3) всегда положительно;
4) положительно или отрицательно в зависимости от обстоятельств.
46. Особенности биохимических процессов: а) подчиняются принципу энергетического сопряжения; б) как правило обратимы; в) сложные; г) только экзэргонические (ΔG < 0); д) большинство необратимо.
1) а, б, в, г; 2) б, в, г; 3) а, б, в; 4) в, д.
47. Экзэргонические реакции протекают в организме самопроизвольно, так как:
1) ΔGреакции > 0; 2) ΔG реакции < 0; 3) ΔGреакции = 0; 4) ΔGреакции ≥ 0.
48. Эндэргонические реакции протекают в организме требуют подвода энергии, так как:
1) ΔGреакции > 0; 2) ΔG реакции < 0; 3) ΔGреакции = 0; 4) ΔGреакции ≥ 0.
49. Реакция 2 H2 + N2 → 2 NH3 проводится при 1100С, так что все реагенты и продукты находятся в газовой фазе. В ходе реакции сохраняется величина:
1) объем; 2) энтропия; 3) энтальпия; 4) масса.
50. При гидролизе любого пептида ΔН < 0, ΔS > 0, самопроизвольно данный процесс протекать…
1) будет, т. к. ΔG > 0; 2) не будет, т.к. ΔG > 0; 3) будет, т.к. ΔG < 0; 4) не будет, т.к. ΔG < 0.
А также по ответам на следующие вопросы:
1. Что называется «термодинамической системой»
2. По каким признакам термодинамические системы делят на изолированные, закрытые, открытые.
3. Приведите формулировку и математическое выражение I начала термодинамики для: а) изолированной системы; б) неизолированной системы.
4. При каких условиях изменение энтальпии ΔН равно теплоте, получаемой системой из окружающей среды.
5. В каких случаях ΔН = ΔU и QV = QP.
6. Что называют тепловым эффектом реакции.
7. Какие процессы называются самопроизвольными.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1017; Нарушение авторских прав?; Мы поможем в написании вашей работы!