
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Беседа по теме занятия
|
|
|
|
Теоретический аспект. Разбор типовых задач.
Задача 1. Расчет теплового эффекта реакции. Определите количество теплоты, выделяемой или поглощаемой при сгорании 4,48 л ацетилена.
Решение: т епловой эффект химической реакции (энтальпию реакции) рассчитывают, используя следствие из закона Гесса:
ΔН0Реакции = 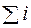 ΔН°обр. (продуктов) -
ΔН°обр. (продуктов) - 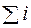 ΔН°обр (исх. веществ)
ΔН°обр (исх. веществ)
Тепловой эффект реакции (или энтальпия реакции) равен сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов реакции.
а) запишем уравнение реакции полного сгорания ацетилена. Расставим коэффициенты и укажем агрегатное состояние всех участников реакции.
б) выпишем из справочной таблицы под уравнение реакции значения стандартных энтальпий образования, ΔН°обр., всех веществ, входящих в уравнение реакции. При этом обратим внимание, что: ΔН°обр простых веществ равна нулю; ΔН°0бр одного и того же вещества различаются в зависимости от агрегатного состояния.
2С2Н2 (г) + 5О2 (г) → 4СО2 (г) + 2Н2О (г)
ΔН°обр, кДж/моль: 227 0 -394 -242
в) запишем следствие из закона Гесса для данной реакции. Подставим в уравнение табличные значения ΔН°Обр с учетом стехиометрических коэффициентов и рассчитаем тепловой эффект реакции горения ацетилена:
ΔН°реакции = [2ΔН0обр. (Н2О) + 4ΔН°0бр.(СО2)] - [2ΔН°обр. (С2Н2) + ΔН°0бр.(О2)] = 2 х (-242) + 4 х (-394) - 2 х 227 - 5 х 0 = - 2514 кДж
Так какΔН < 0, реакция экзотермическая. Знак минус свидетельствует о выделении тепла в реакции. Определим количество тепла, выделяющегося при сгорании 4,48 л. ацетилена.
1 моль газа - 22,4 л 2 моль - 2514 кДж
х - 4,48 л х = 0,2 моль Тогда 0,2 моль - у у = 251,4кДж
Ответ: При сгорании 4,48 л ацетилена выделится 251,4 кДж тепла.
Для органических веществ проще определить стандартную теплоту сгорания, чем ΔН°обр тогда для расчета теплового эффекта органических реакций можно использовать 3-е следствие из закона Гесса: (если известны теплоты сгорания веществ, участвующих в реакции)
ΔН0реакции = 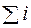 ΔН0сгор -
ΔН0сгор - 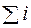 ΔНсгор
ΔНсгор
исх. в-в продуктов
Задача 2: Определение возможности самопроизвольного протекания процесса. Определите, возможно ли самопроизвольное протекание реакции образование аммиака из простых веществ при 100°С?
Решение: Реакция может протекать самопроизвольно, т.е. без подвода энергии извне, если энергия Гиббса в ходе реакции уменьшается. Это критерий возможности самопроизвольного протекания реакции в закрытых и открытых системах: ΔG < 0
Изменение энергии Гиббса реакции, протекающей в стандартных условиях, находят, используя следствие из закона Гесса:
ΔG°peaции = 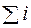 ΔG°(продуктов) –
ΔG°(продуктов) – 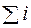 ΔG°(иcx. Веществ)
ΔG°(иcx. Веществ)
Изменение энергии Гиббса реакции, протекающей в нестандартных условиях (не при 298 К), находят, используя объединенное уравнение I и II начал термодинамики. Поскольку по условию задачи реакцию синтеза аммиака проводят при 100°С, т.е. в нестандартных условиях, поэтому изменение энергии Гиббса реакции следует рассчитывать по объединенному уравнению.
а) записываем уравнение химической реакции, расставляя коэффициенты и указывая агрегатные состояния всех участников реакции.
б) выписываем из справочной таблицы под уравнением реакции значения стандартной энтальпии образования, ΔН°обр и абсолютной энтропии S°298, Для каждого участвующего в реакции вещества. Следует отметить, что абсолютные энтропии простых веществ не равны нулю.
N2(r)+3H2(r)→2NH3(r)
ΔН°обр,кДж/моль: 0 0 -46
S°298, Дж/(моль*К) 192 131 193
в) рассчитаем тепловой эффект реакции, ДН0реакции3 используя следствие из закона Гесса:
ΔН°реакции = 2ΔH°o6p(NH3) - [ΔH°o6p(N2) + ЗΔН°обр(Н2) = 2 х (-46) - 0 - 3 х 0 = -92 кДж
ΔН°реакции < 0, реакция экзотермическая
г) рассчитываем изменение энтропии реакции, используя следствие из закона Гесса:
ΔS°peaкции = 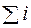 S°298(продуктов) -
S°298(продуктов) - 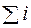 S°298 (исх. веществ)
S°298 (исх. веществ)
ΔS°Pеакции = 2S°298(NH3) - [S°29g(N2) + 3S°298(H2)] = 2 x 193 - (192 + 3x131) = -199 Дж/К
ΔS0 < 0 - энтропия реакции убывает.
Изменение энтропии является критерием самопроизвольного протекания реакции только для изолированных систем (не обменивающихся с окружающей средой ни энергией, ни веществом). При самопроизвольном протекании реакции в изолированной системе энтропия должна возрастать, т.е. AS > 0.
д) для оценки возможности протекания реакции в реальных закрытых и открытых системах нужно рассчитать изменение энергии Гиббса, используя объединенное уравнение I и II начал термодинамики.
Обратим внимание, что: температура должна быть выражена в абсолютной шкале температур, т.е. в Кельвинах: Т = t° + 273 = 100 + 273 = 373 К, а энтальпия и энтропия реакции должны быть выражены в одних единицах - в килоджоулях: ΔS°peaкции = -0,199 кДж/К
ΔG = ΔН0- T*ΔS° = -92 - 373 * (-0,199) = -17,8 кДж
Ответ: ΔG < 0, следовательно данная реакция при 100°С может протекать самопроизвольно. Решающим оказался энтальпийный фактор, т.к. ΔН< 0.
Задача 3: Расчеты калорийности продуктов питания. Рассчитайте, какую энергию получает человек, съедая 150 г вареной колбасы, если ее состав: белки 12,3%, жиры 25,3%.
Решение: основная часть энергии питательных веществ выделяется в организме при их окислении. Энергия, выделяемая при полном окислении (сгорании) питательных веществ, называется их калорийностью. Расчет калорийности продуктов питания основан на I законе термодинамики (законе Гесса), поскольку питательные вещества в организме окисляются до тех же веществ, что и вне организма, например, в калориметре. Калорийности пищи из-за ее сложного состава принято указывать в расчете на 1 г, а не на моль. Химический состав продуктов питания характеризуют содержанием белков, жиров и углеводов - основных компонентов пищи. Их калорийность:
| белки | кДж/г | 4 ккал/г | |
| жиры | кДж/г | 9 ккал/г | |
| углеводы | кДж/г | 4 ккал/г |
1 калория = 4,18 Дж
а) зная содержание в продукте белков, жиров и углеводов, удобно сначала определить, сколько энергии выделяется при усвоении 100 г продукта.
Так, состав колбасы: 12,3% белков и 25,3% жира, означает, что в 100 г ее содержится 12,3 г белков и 25,3г жира. Найдем энергию, которая выделится при усвоении:
ΔНсгор(белков) = 17 кДж/г * 12,3 г = 209,1 кДж
ΔНсгор(жиров) = 38 кДж/г * 25,3 г = 961,4 кДж
ΔНсгор(100 г колбасы) = 209,1 + 961,4 = 1170,5 кДж
б) рассчитаем, сколько энергии дают организму 150 г колбасы
100 г - 1170,5 кДж
150 г - х х = 1755 кДж или 419 ккал
Ответ: Съедая 150 г вареной колбасы, человек получает энергии 1755 кДж.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 592; Нарушение авторских прав?; Мы поможем в написании вашей работы!