
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практическая работа
|
|
|
|
1) Выполнить лабораторную работу «Определение энтальпии различных химических процессов».
2) Цель работы: Овладеть навыками экспериментального определения энтальпии химических процессов на примере реакции нейтрализации и процессов растворения химических соединений.
3) Методика проведения работы.
Определение теплоты, выделяемой или поглощаемой при протекании химического процесса, осуществляется с помощью калориметра. Калориметр – устройство, в котором количество теплоты, выделяемой или поглощаемое в ходе процесса, измеряется по изменение температуры калориметра. Калориметр состоит из двух сосудов – внешнего и внутреннего, пространство между которыми представляет воздушную изотермическую оболочку для предотвращения потерь теплоты. Крышка внутреннего сосуда снабжена отверстиями для ручной мешалки, воронки для введения веществ, термометра для измерения температуры.
Опыт 1. Определение энтальпии нейтрализации сильной кислоты щелочью
| Варианты | ||||
| Кислота | HCl | HCl | HNO3 | HNO3 |
| Щелочь | NaOH | KOH | NaOH | KOH |
Уравнение реакции нейтрализации: HCl (p) + NaOH (p) = NaCl (р) + H2O (ж)
Н+ (р) + ОН- (р) = H2O (ж)
Расчет энтальпии нейтрализации сильной кислоты щелочью ведется по кратному ионному уравнению, которое отражает сущность взаимодействия сильных электролитов.
1. Взвесьте внутренний сухой стакан калориметра с точностью до 0,1 г.
2. Налейте в него 25 мл 2н раствора кислоты и измерьте начальную температуру раствора.
3. Быстро прилейте 25 мл 2н раствор щелочи, перемешайте и определите конечную температуру смеси – наивысшую температуру раствора.
4) Результаты представить в виде заполненной таблицы:
| t | t | ∆t | Теплота, пошедшая на нагревание смеси | Теплота, пошедшая на нагревание стакана | |||||
| Vp | ρp | Cp | Q1 | m | C | Q2 | |||
Расчет количество теплоты, которое выделилось при нейтрализации и пошло на нагревании смеси, произвести по формуле: Q1 = Cp ρp Vp ∆t,
где Vp – суммарный объем раствора, мл;
ρp – плотность раствора, для разбавленных растворов принимается равной плотности воды,
т.е. 1 г/мл;
Cp – удельная теплоемкость раствора, равная 3,5 Дж/(г К);
∆t – разность между конечной и начальной температурами.
Расчет количество теплоты, пошедшее на нагревание стакана, произвести по формуле:
Q2 = C m ∆t,
где m – масса стакана, г;
С – удельная теплоемкость стекла, равная 0,838 Дж/(г К).
Расчет экспериментальной энтальпии реакции нейтрализации для одного моль эквивалентов кислоты произвести по формуле:
ΔНнейтр. = -(Q1 + Q2) / nэ [Дж/моль],
где nэ - число моль эквивалентов кислоты, взятое для реакции, которое рассчитывают по формуле: nэ = СHCl VHCl.
(Повышение температуры в калориметре свидетельствует о том, что энтальпия системы уменьшилась).
Сравните полученный результат с рассчитанным теоретическим значением и вычислите относительную ошибку опыта:
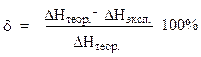
5) В выводе ответьте на следующие вопросы:
а) По изменению температуры опыта укажите, экзо- или эндотермической является реакция нейтрализации сильной кислоты щелочью? Какой знак имеет энтальпия этой реакции?
б) Объясните, почему энтальпия нейтрализации сильной кислоты щелочью не зависит от природы кислоты или щелочи и является величиной постоянной.
Опыт 2. Определении энтальпии растворения вещества
| Варианты | ||
| Соль | КCl | Na2CO3 |
| Навеска, г | 7,45 | 10,60 |
Уравнения физико-химического процесса растворения солей:
KCl (т) + n H2O = K+ (p) + Cl- (p) ΔН растворения (KCl)
Na2CO3 (т) + n H2O = 2 Na+ (p) + CO32- (p) ΔН растворения (Na2CO3)
Теплота растворения твердого вещества в жидкости складывается из тепловых эффектов двух стадий: а) затраты энергии на разрушение кристаллической решетки, ΔН реш. > 0; б) выделения энергии в результате взаимодействия растворяемого вещества с растворителем с образованием сольватной (гидратной) оболочки, ΔН гидр. < 0.
ΔН растворения = ΔН реш. + ΔН гидр.
Суммарная (интегральная) теплота растворения может быть положительной или отрицательной в зависимости от соотношения величин обоих слагаемых. Она равна количеству теплоты, выделившейся или поглощенной при растворении 1 моль веществ в большом объеме растворителя (кДж/моль).
1. В калориметр при помощи мензурки налейте 100 мл дистиллированной воды и измерьте начальную температуру.
2. Высыпьте в калориметр приготовленную навеску безводной соли.
3. непрерывно помешивая раствор мешалкой, наблюдайте за изменениями температуры в течение 6-10 минут с интервалом в 1 минуту.
4. Результаты занесите в таблицу.
| Время начала опыта, мин | |||||||||
| Температура, 0С | tнач |
Определите максимальную температуру tконеч. и вычислите разность температур:
Δt = (tконеч. – tнач.)
Расчет энтальпии растворения 1 моль соли произвести по формуле:
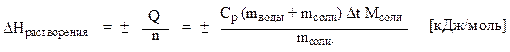
где (mводы + mсоли) – масса раствора, равная сумме масс воды и соли, г;
Ср – удельная теплоемкость раствора, равная 3,8 Дж/ (г К);
Мсоли – молярная масса соли, г/моль;
mсоли – навеска соли, г.
Сравните полученный результат с табличными значениями теплоты растворения солей:
ΔНрастворения (КСl) = + 17,28 кДж/моль ΔНрастворения (Na2CO3) = - 23,60 кДж/моль
Рассчитайте относительную ошибку в процентах. В выводе отметьте причину отклонения экспериментально найденной величины ΔНрастворения от табличного значения; укажите, экзо- или эндотермическим является процесс растворения каждой соли.
4. Задачи для самостоятельного разбора на занятии:
1. Пользуясь табличными данными, рассчитайте тепловые эффекты следующих реакций:
а) С2Н5ОН (г) + 1/2 О2 (г) → СН3СООН (ж) + Н2О (ж) б) С6Н12О6 (т) → 2С2Н5ОН (ж) + 2СО2 (г)
2. Рассчитайте тепловой эффект реакции гидратации 2,24 л этилена до этилового спирта в стандартных условиях.
3. Вычислите стандартную теплоту образования сахарозы C12H22O11 если тепловой эффект реакции:
C12H22O11(Т) + 12О2 (г)→ 12СО2(г)+ 11Н2О(Ж) равен - 5694 кДж.
4. Ферментативное дегидрирование пропанола-2 протекает по следующему уравнению:
Фермент
CH3-CH(OH)-CH3 → CH3-CO-CH3 + H2
Определите, какое количество энергии выделится или поглотится при этом, если известны энтальпии сгорания веществ (кДж/моль): ΔН°298(пропанола) = -2002, ΔН°298(ацетона) = -1789, ΔН°298(Н2) = - 285.
5. Напишите уравнение реакций, тепловой эффект которых был бы стандартной теплотой образования глюкозы; азотной кислоты; аммония хлорида.
6. Рассчитайте, сколько энергии получает грудной малыш при искусственном вскармливании 100 г молочной смеси "Детолакс", имеющей состав: белки 13,7%, жиры 27%, углеводы 53%. Сколько такой смеси требуется ребенку массой 4 кг, если суточная потребность энергии у детей первых трех месяцев жизни составляет в среднем 500 кДж/кг или 120 ккал/кг?
7. Подсчитайте калорийность традиционного завтрака англичан, съедающих около 300 г овсяной каши, имеющей состав: белки 9%, жиры 1,4%, углеводы 70%.
8. Стандартная теплота образования NH3 и РН3 равна соответственно -46,2 и +5,1 кДж/моль. Какой следует сделать вывод из этих данных об относительной устойчивости молекул NH3 и РН3?
9. Не проводя расчета, определите, как изменяется энтропия в следующих реакциях:
NH3 (г) + НС1 (г) → NH4C1 (т) СОС12 (г) → СО2 (г) + С12 (г) РС13 (г) + С12 (г) → РС15(г)
10. Определите возможность самопроизвольного протекания в стандартных условиях следующей реакции:
CH3-CO-CH3 + H2 → СН3СН2ОН(Ж)
11. Дайте заключение о направлении самопроизвольного протекания реакции при 370С. Определите, какой фактор энтальпийный или энтропийный оказался решающим:
СН3СООС2Н5 (Ж) + Н2О (ж) → СН3СООН (ж) + С2Н5ОН (ж)
Для этилацетата: ΔН°о6р= -469,5 кДж/(моль К), S°298= 259 кДж/(моль К); для СН3СООН: S°298= 160 кДж/(моль К)
12. Определите, каким процессом в организме: экзо - или эндоэргоническим является окисление молочной кислоты в пировиноградную (при 37°С):
Фермент
CH3-CH(OH)-CH3 → CH3-CO-CH3 + H2
ΔН°о6р, кДж/моль -673 -586 0
S°298, Дж/ (моль К) 192 179 131
13. Фосфорилирование глюкозы: глюкоза + фосфат = глюкозо-6-фосфат – эндоэргонический процесс (ΔG0 = 13.3 кДж/моль) и сопряжен с гидролизом АТФ (ΔG0 = -30,5 кДж/моль). Запишите уравнение суммарной реакции и рассчитайте для нее ΔG0.
14. Синтез дипептида аланилглицина сопряжен с гидролизом АТФ: аланин + глицин + АТФ = аланилглицин + АДФ + фосфат, ΔG0 = -13.3 кДж/моль. Рассчитайте ΔG0 для реакции синтеза дипептида в отсутствии АТФ, если для гидролиза АТФ ΔG0 = -30,5 кДж/моль.
15. Вычислите ΔG0 процесса: ацетилфосфат + АДФ = ацетил + АТФ, если известно, что для гидролиза ацетилфосфата ΔG0 = -43,1 кДж/моль, а для гидролиза АТФ ΔG0 = -30,5 кДж/моль.
Рекомендуемая литература:
Основная:
1. В.А. Попков, С.А. Пузаков Общая химия: Учебник. - М.: ГЭОТАР-Медиа. - 2010.
2. С.А. Пузаков, В.А. Попков. Сборник задач и упражнений по общей химии. - М.: Высшая школа. – 2004.
Дополнительная:
1. В.И. Слесарев. Основы химии живого.- Санкт-Петербург: Химиздат.- 2001.
2. А.В. Суворов, А.Б. Никольский. Вопросы и задачи по общей химии. – Санкт-Петербург: Химиздат. – 2002.
Методические указания подготовлены: доцентами Н.И. Никитиной и Е.И. Казаковой
Методические указания утверждены на заседании кафедры №_____ от «___» ________20___ г.
Зав. кафедрой: _____________________________/Е.И. Казакова
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2207; Нарушение авторских прав?; Мы поможем в написании вашей работы!