
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перше начало термодинаміки. Робота, енергія, теплота
|
|
|
|
Другий постулат термодинаміки. Рівняння стану, їх виведення для ід. газу і парамагнетика.
Якщо система задається внутр. енергією, то ї стан задається таким чином:

і таке рівняння наз-ть калорічним рівнянням стану.
Якщо стан системи задається тд. силами, то по 2му постулату:
 - термічне рівняння
- термічне рівняння
Кількість цих рівнянь дорівнює кількості тд. сил. Для того, щоб визначити тд. стан системи, треба задати 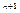 рівняння стану. Розглянемо
рівняння стану. Розглянемо 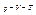 систему (на неї діє
систему (на неї діє  , параметрами стану є
, параметрами стану є  ). Маємо рівняння стану:
). Маємо рівняння стану:
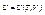
і термічне рівняння:
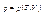
Стан системи описується 2ма рівняннями. Якщо газ ідеальний, то для одного моля:
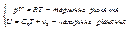
Якщо система ізольована, то її енергія не змінюється. 1 начало тд-ки:
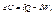
де  - дві форми енергії.
- дві форми енергії.
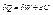
Формули для роботи, теплоти, енергії:
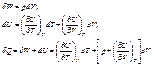 4. Друге начало термодинаміки для квазістат. процесів. Мат. обґрунтування існування ентропії.
4. Друге начало термодинаміки для квазістат. процесів. Мат. обґрунтування існування ентропії.
Квазістатичні процеси ідуть так повільно, що в деякий інтервал часу можна вважати, що деяка фіз. вел-на є сталою. Біля кожного стану рівноважної однорідної системи будуть існувати такі стани, які недосяжні адіабатично. Нехай є стани 1 і 2:

За 1шим началом тд-ки (до переходу 1-2):

Після адіабатичного переходу 1-2:
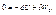
Складемо ці рівняння:
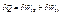
Робота була виконана без компенсації, а цього бути не може. Отже із стану 2 в 1 адіабатично перейти не можна. Робимо висновок, що існує деяка нова ф-ція стану:
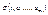 - ентропія, де
- ентропія, де
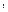 - емпірична темп-ра,
- емпірична темп-ра, 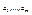 - зовн. параметри,
- зовн. параметри,  - параметри стану. В нашому процесі
- параметри стану. В нашому процесі 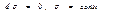 .
.
В стані 1 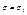 , в стані 2
, в стані 2 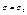 , тобто перейти з стану 2 в 1 при
, тобто перейти з стану 2 в 1 при 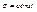 неможливо. при адіабатному процесі
неможливо. при адіабатному процесі 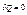 .
.
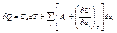
і 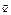 , і
, і  залежать від
залежать від  сукупності параметрів, тобто
сукупності параметрів, тобто 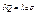 . Вони одночасно дорівнюють нулю в адіабатному процесі.
. Вони одночасно дорівнюють нулю в адіабатному процесі.
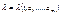
 де
де
 - ф-ція стану,
- ф-ція стану, 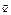 - ф-ція процесу.
- ф-ція процесу.
З мат. аналізу відомо, що якщо ф-ція не є повним диференціалом, то її можна зробити повним диференціалом. Якщо виберемо такй множник, що залежить лише від 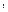 :
:  , то можна показати, що вигляд функції
, то можна показати, що вигляд функції 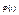 буде різним в залежності від того, яку емпіричну температуру ми виберемо. Для різних емпіричних температур функції
буде різним в залежності від того, яку емпіричну температуру ми виберемо. Для різних емпіричних температур функції 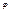 матимуть різний вигляд
матимуть різний вигляд  але абсолютна температура, що відповідає цим емпіричним, є однією і тією самою.
але абсолютна температура, що відповідає цим емпіричним, є однією і тією самою. 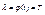
Якщо  , то функція стану зветься ентропією.
, то функція стану зветься ентропією.
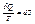 - визначення 2-го начала термодинаміки.
- визначення 2-го начала термодинаміки.
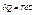 , де Т- термодинамічна сила, S-координата.
, де Т- термодинамічна сила, S-координата. 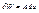 . Якщо процес адіабатичний
. Якщо процес адіабатичний 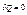 то
то 
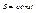
Тобто при квазістатичних процесах в ізольваній системі 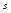 не змінюється.
не змінюється.
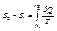 - формула для обчислення ентропії, (1)
- формула для обчислення ентропії, (1)
і (2) – стани.
2-м началом термодинаміки обчислюємо абсолютне значення 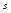 , а її зміну. Для того, щоб знайти абсолютне значення
, а її зміну. Для того, щоб знайти абсолютне значення 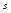 , треба ввести деякий детермінований стан.(тобто стан в якому ми знаємо значення
, треба ввести деякий детермінований стан.(тобто стан в якому ми знаємо значення 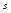 ). Таким чином є стан біля абсолютного нуля (
). Таким чином є стан біля абсолютного нуля (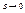 ). Тоді інтеграл береться від (0).
). Тоді інтеграл береться від (0).
З принципу адіабатичної недосяжності отримали, що диференційну форму  можна зробити повним диференціалом діленням на інтегруючий дільник
можна зробити повним диференціалом діленням на інтегруючий дільник  .Покажемо, що серед усіх
.Покажемо, що серед усіх  існують такий, що залежить лише від емпіричної температури t, тобто
існують такий, що залежить лише від емпіричної температури t, тобто 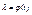 , і визначає ентропію
, і визначає ентропію  системи, причому головне значення
системи, причому головне значення 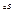 не залежить від вибору
не залежить від вибору 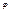 .
.
Існування 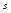 . Нехай є дві підсистеми, що знаходяться в тепловій рівновазі. Стан 1-ї визначається параметрами
. Нехай є дві підсистеми, що знаходяться в тепловій рівновазі. Стан 1-ї визначається параметрами 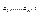
другої  всієї системи в цілому –параметрами
всієї системи в цілому –параметрами 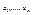
 . Нехай в деякому рівноважному процесі системам надали теплоти
. Нехай в деякому рівноважному процесі системам надали теплоти 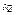 і
і 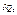 ,
,  (1)
(1)
Усі ці елементи головні: 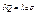

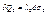 , де
, де 
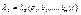
 - інтегруючі дільники;
- інтегруючі дільники;  і
і 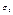 - функції стану систем, їх можна взяти в якості незалежних змінних кожної з систем, наприклад замість
- функції стану систем, їх можна взяти в якості незалежних змінних кожної з систем, наприклад замість 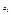 і
і 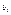 :
:
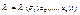
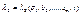
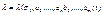
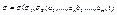
(3) 
З (1) і (2) маємо 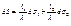 (4)
(4)
З (3) і (4) маємо 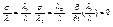
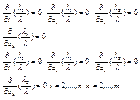
З 3 – ї і 4 – ї рівності маємо
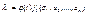

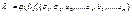
Оскільки 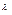 не залежить від
не залежить від 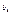 , а
, а 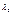 від
від  то з рівностей 5-8 маємо, що
то з рівностей 5-8 маємо, що  не залежить від
не залежить від  і
і 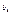 ,
, 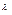 від
від  ,
, 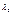 від
від 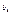 .Тоді
.Тоді
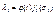


Функції 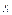 і
і  ,
, 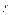 довільні. Можемо підібрати функції
довільні. Можемо підібрати функції 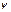 так, що
так, що 
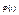 є однаковим для всіх систем, що знаходяться в тепл. рівновазі. Функція
є однаковим для всіх систем, що знаходяться в тепл. рівновазі. Функція  , що визначається рівнянням
, що визначається рівнянням 
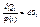 називається ентропією 1-ї системи, відповідно
називається ентропією 1-ї системи, відповідно 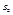 , що
, що
Ввиводиться з рівняння 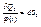

5. начало термодинаміки для нестац. процесів. Імовірнісний зміст ентропії.
Для нерівноважної системи:
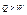

Перейдемо зі стану 1 в стан 2 нестатично, а потім квазістатично. В першому випадку повернутись в стан 1, не змінюючи окіл, неможливо, а у другому – можливо.
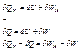
У другому випадку системі надали тепло, і вона виконала роботу. Робота призвеладо виділення тепла
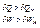

Якщо система адіабатично ізольована, то 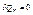 . Тоді
. Тоді  . В неізольованій системі можна примусити
. В неізольованій системі можна примусити 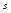 спадати. Нерівність Клазіуса:
спадати. Нерівність Клазіуса:

Ентропія – ф-ція стану, і цей інтеграл не є мірою зміни ентропії. Для того, щоб обчислити 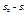 , систему треба перевести зі стану 1 в стан 2 рівноважно.
, систему треба перевести зі стану 1 в стан 2 рівноважно.
Співвідношення Планка-Гіббса:
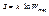 , де
, де 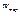 - тд. ймовірність. Це число мікростанів системи, які відповідають одному й тому ж макростану.
- тд. ймовірність. Це число мікростанів системи, які відповідають одному й тому ж макростану.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 513; Нарушение авторских прав?; Мы поможем в написании вашей работы!