
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зв'язок термічного і калорічного рівняння стану, приклади його застосування
|
|
|
|

S-функція стану.
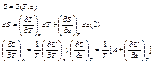 Виконаємо ту властивість, що мішані похідні дорівнюють:
Виконаємо ту властивість, що мішані похідні дорівнюють:

(*)  - зв'язок термічного і калорійного рівняння стану. Це рівняння буде використано для отримання калорічного рівняння із термічного.
- зв'язок термічного і калорійного рівняння стану. Це рівняння буде використано для отримання калорічного рівняння із термічного.
Термічне рівняння стану як правило відомо.
Калорічне знаходиться важко.
(*)à (для P-V-T системи)à

P=P(T,V)-дано
U=U(T,V)-знайти
рV=RT
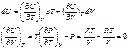
 для ідеального газу
для ідеального газу
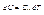
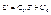 - калорічне рівняння
- калорічне рівняння
Внутрішня енергія дуже розрідженого ідеального газу не залежить від об’ему. Для газу Ван-дер-Ваальса
 а і б сталі В-д-В
а і б сталі В-д-В
При рівноважних процесах ентропія постійна.
7. Заг. властивості термодинамічних потенціалів, їх обґрунтування.
Термодинаміка має технічний метод (циклів), аналітичний (потенціалів). Термодинамічні потенціали (або характеристичні функції) описують власні стани у певних умовах. Всі потенціали мають 3 загальні властивості:
1)вони є однозначними функціями стану;
2)зменшення потенціалу дорівнює роботі, яку виконує система у певних умовах;
3)всі потенціали в стані рівноваги мінімальні.
Щоб ввести потенціали, будемо виходити з основного рівняння термодинаміки P-V-T системи:
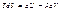
1)Умови виділення системи з околу:
S, V=const (це незалежні змінні)
U=U(S,V) (у цьому ізольованому околі ідуть лише адіабатичні і ізохорні процеси)
dU=TdS-PdV (#) – диференціальне співвідношення для повної енергії.
2)Якщо розглянемо адіабатичний процес, то
dU=-PdV= 
 (робота = зменшенню потенціалу внутрішньої енергії). 3(#):
(робота = зменшенню потенціалу внутрішньої енергії). 3(#):

Системи характеризують CP, CV стисливість (P(T),P(V)), T(P), T(V).
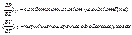
Ці висновки відрізняються ізохорним і адіабатичним процесами.

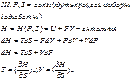
Робота при певних умовах дорівнює зменшенню потенціалу.
Якась енергія

U – енергія газу
PV – енергія поршня
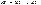
При адіабатному процесі S=const, 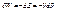
Для поширеної системи робота є –VdP. Бачимо, що ця енергія і є ентальпія.
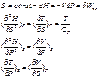
IV. Незалежні змінні T, P=const (ці умови легше всього підтримувати практично)
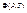 - енергія Гібса
- енергія Гібса
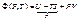

Якщо  , то
, то 

 - рівність Максвела
- рівність Максвела
Потенціали дають можливість знайти величини системи у певних умовах(знайти термічне поширення, стисливість…)
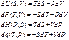
Т.д потенціали для P-V-T системи при сталій кількості частинок. Всі потенціали з осн. рівняння термодинаміки для квазістатичних процесів.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1016; Нарушение авторских прав?; Мы поможем в написании вашей работы!