
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы термохимии
|
|
|
|
Первый закон термодинамики
Первый закон термодинамики - это закон сохранения энергии для систем, в которых энергия выделяется или поглощается в виде теплоты или работы.
Поглощенная системой теплота расходуется на увеличение внутренней энергии системы и на совершение системой работы:
Q = D U + A (1)
При химических процессах чаще всего совершается работа расширения, равная pDV, которую выделяют из общей суммы:
A = A/ + pDV
где A/ - полезная работа;
р – внешнее давление;
DV- изменение объема системы.
Подставляя полученное выражение в уравнение (1), получаем:
Q = DU + A/ + p DV
В большинстве химических процессов полезная работа не совершается (исключение – работа гальванического элемента) и A/ = 0. Тогда:
Q = DU + p DV
Величина Q называется тепловым эффектом процесса.
Обычно химические процессы протекают при постоянстве одного из параметров.
р = const – изобарический процесс;
V= const – изохорический процесс;
T = const – изотермический процесс.
Рассмотрим вид первого начала термодинамики для изохорического и изобарического процессов.
1) V = const DV = 0
QV = DU
Тепловой эффект изохорного процесса QV равен изменению внутренней энергии системы.
2) p = const
QP = DU + p DV
DU = U2 - U1 DV = V2 - V1
Qp = (U2 - U1) + p (V2 - V1)
QP = (U2 + pV2) – (U1 + pV1)
U + pV = H – энтальпия
QP = H2 - H1
QP = DH
Тепловой эффект изобарического процесса QP равен изменению энтальпии системы. Для процессов, протекающих при p=const, изменения энтальпии и внутренней энергии связаны соотношением:
DH = DU + p DV
Энтальпия, как и внутренняя энергия, является функцией состояния системы. Ее абсолютное значение неизвестно. Экспериментально может быть определена величина DH, как тепловой эффект процесса, проведенного при p=const. Энтальпию измеряют в джоулях и килоджоулях.
Согласно первому закону термодинамики, в общем случае, теплота не является функцией состояния системы. Однако при p = const QP = DH, а при V = const QV = DU и, следовательно, в этих двух случаях теплота является функцией состояния системы, что и устанавливает закон Гесса:
Тепловой эффект химической реакции, протекающей при p = const или V = const не зависит от пути процесса, а определяется только начальным и конечным состояниями реагирующих веществ.
Тепловой эффект процесса может быть положительным (DH>0, теплота поглощается системой) или отрицательным (DH<0, теплота выделяется системой в окружающую среду). В первом случае процесс называется эндо-, а во втором – экзотермическим.
Для практических расчетов используются следствия из закона Гесса.
1-ое следствие:
Тепловой эффект процесса равен сумме тепловых эффектов отдельных стадий.
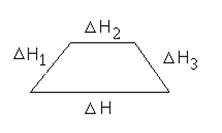
DH = DH1 + DH2 + DH3
2-ое следствие:
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
Для реакции:
a A + b B = c C + d D
DHр-ции = (c DHобр С + d DHобр D) – (a DHобр A + b DHобр B)
Теплота образования сложного вещества (DHобр) есть тепловой эффект процесса образования одного моля этого вещества из простых веществ в их устойчивых состояниях.
Так, теплотой образования карбоната кальция является тепловой эффект процесса:
Ca(к) + C (гр) + 3/2 O2(Г)= CaCO3(К) 
Стандартной теплотой образования химического соединения при данной температуре (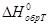 ) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ при стандартном состоянии (p=101325Па, c=1 моль/л, устойчивые модификации простых веществ)
) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ при стандартном состоянии (p=101325Па, c=1 моль/л, устойчивые модификации простых веществ)
Стандартные энтальпии образования простых веществ принимаются равными 0.
В таблицах приводятся величины стандартных энтальпий образования, измеренные при стандартной температуре 298К -  . Величина
. Величина 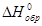 зависит от количества вещества и измеряется в кДж/моль.
зависит от количества вещества и измеряется в кДж/моль.
Уравнения, в которых приводится тепловой эффект процесса называются термохимическими уравнениями, например:
N2(г)+ 3 H2(г) =2 NH3(г) 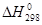 = - 92,4 кДж
= - 92,4 кДж
Особенности термохимических уравнений:
1) стехиометрические коэффициенты означают число молей, а не число молекул и поэтому могут быть дробными;
2) в них всегда указывается агрегатное состояние веществ и их модификация;
3) величина приводимого теплового эффекта соответствует тому числу молей веществ, которое определяется уравнением реакции;
4) к ним применимы математические операции, которые используются для алгебраических уравнений.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 995; Нарушение авторских прав?; Мы поможем в написании вашей работы!