
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтальпийный и энтропийный факторы процесса. Энергия Гиббса
Направление протекания процесса определяется двумя противоположными тенденциями:
1) стремлением системы перейти в состояние с наименьшей энергией;
2) стремлением системы перейти в состояние с наибольшей энтропией.
В реальных химических процессах происходит одновременное изменение и энтальпии, и энтропии системы. Для учета обоих этих факторов вводится новая функция состояния системы:
G = H – TS
G – энергия Гиббса; свободная энергия; изобарно-изотермический потенциал.
Для процессов, протекающих при T=const и p=const:
DG = DH - TDS
Изменение энергии Гиббса равно по абсолютной величине максимальной полезной работе, которую может совершить система:
DG = - Amax
Таким образом общий энергетический эффект процесса DН можно представить как сумму двух составляющих:
DH = DG + TDS,
где DG – это та часть энергии, которую можно превратить в работу (“свободная” энергия); TDS – “связанная” энергия, которая ни при каких условиях не может быть превращена в работу и неизбежно рассеивается в виде теплоты.
Знак величины DG однозначно определяет направление самопроизвольного протекания процесса в изобарно-изотермических условиях. Согласно второму закону термодинамики:
При p=const и T=const самопроизвольно могут протекать процессы в направлении уменьшения энергии Гиббса (DG<0).
Термодинамические процессы могут быть обратимыми и необратимыми. Обратимые процессы заканчиваются установлением равновесия. Равновесие – это такое состояние системы, при котором все ее параметры остаются постоянными как угодно долго при отсутствии внешних воздействий. Равновесие – это динамическое состояние. Оно означает не отсутствие процессов в системе, а равенство скоростей прямого и обратного процессов.
Процесс будет протекать самопроизвольно только в направлении, приближающем систему к состоянию равновесия. В состоянии равновесия энергия Гиббса принимает минимальное значение и не изменяется:
DG<0 – процесс протекает самопроизвольно в прямом направлении;
DG=0 – состояние равновесия
DG>0 – самопроизвольное протекание прямого процесса невозможно (самопроизвольно протекает обратная реакция, для которой DG<0).
Соотношение энтальпийного (DН) и энтропийного (TDS) факторов процесса:
1) если DН<0 и DS>0, то DG<0 всегда, т.е. процесс протекает самопроизвольно при любых Т;
2) если DН>0 и DS<0, то DG>0 всегда, т.е. процесс невозможен ни при каких Т;
3) если DH<0 и DS<0, то DG<0) при условии ÷DHô>ôTDS÷, т.е. процесс протекает самопроизвольно при низких температурах;
4) если DH>0 и DS>0, то DG<0) при условии ÷DHô<ôTDS÷, т.е. процесс протекает самопроизвольно при высоких температурах.
Энергия Гиббса – это функция состояния системы. Ее изменение DG в процессе может быть рассчитано на основании закона Гесса и его следствий. Стандартные энергии Гиббса образования веществ D 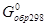 [кДж/моль] приводятся в справочных таблицах. Стандартные энергии Гиббса образования простых веществ принимаются равными нулю.
[кДж/моль] приводятся в справочных таблицах. Стандартные энергии Гиббса образования простых веществ принимаются равными нулю.
Для того чтобы определить, будет ли процесс протекать самопроизвольно при стандартном состоянии и данной температуре, необходимо рассчитать D 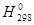 и D
и D 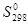 процесса, а затем определить знак D
процесса, а затем определить знак D 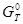 при данной температуре.
при данной температуре.
|
|
Дата добавления: 2015-05-09; Просмотров: 1221; Нарушение авторских прав?; Мы поможем в написании вашей работы!